和元生物技术(上海)股份有限公司品牌商
13 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
公司新闻/正文
Cell|刘真/孙怡迪/李昊合作建立灵长类大脑细胞类型特异性靶向研究工具集,精准调控不再是难题
107 人阅读发布时间:2025-09-09 13:09
灵长类(猕猴)动物大脑神经细胞类型多样、脑区结构复杂,是解析高等认知功能(如语言、决策、社会行为)的理想模型。解析行为认知背后复杂的神经环路是理解大脑工作原理的关键,而神经环路由不同细胞类型通过复杂联接形成。然而,由于缺乏细胞类型特异性靶向方法,用于监测和操纵神经元活动的遗传靶向技术在灵长类大脑研究中应用有限。以往的研究大量依赖于小鼠模型,并开发了强大的遗传工具(如Cre转基因小鼠品系)可实现神经细胞类型特异性的标记,从而开启了神经环路精细化研究的时代。灵长类动物转基因品系构建周期长、技术难度高、资源投入大,因此传统的Cre转基因策略有很大的局限性。
增强子序列是调控基因特异性表达的关键元件,利用特定的增强子可以驱动外源基因在对应细胞类型中的表达。然而,迄今为止,灵长类大脑神经细胞类型特异性增强子的研究尚处于起步阶段,建立能够特异性靶向灵长类大脑不同细胞类型的增强子工具集该领域的重大需求。
2025年7月10日,中国科学院脑智卓越创新中心/上海脑科学与类脑研究中心刘真研究组、脑智卓越中心孙怡迪研究组、临港实验室李昊研究组合作在国际学术期刊 Cell 在线发表了题为“Identification and Application of Cell Type-Specific Enhancers for the Macaque Brain”的研究论文,该研究率先建立了灵长类大脑神经细胞类型特异性标记、神经活性调控及观测的工具集,为深入理解灵长类脑结构、脑认知及脑疾病提供了关键技术。

结 果
首先,研究团队借助单细胞转录组(SnRNA-seq)、空间转录组(Stereo-seq)及单细胞表观组(SnATAC-seq)对猕猴全脑进行单细胞多组学分析,建立了猕猴大脑细胞特异性增强子分析和预测流程,并获得了猕猴不同神经细胞类型的一批潜在候选增强子序列。随后,针对灵长类大脑不同兴奋性神经元、GABA能神经元和胶质细胞,研究团队建立了猕猴大脑通量AAV病毒注射和筛选流程,他们设计并构建了利用增强子靶向上述细胞类型的109种荧光报告载体(AAV-Enhancer-mBG-copGFP),并包装到AAV-PHP.eB血清型中,注射到猕猴大脑皮层,注射后3周取脑组织进行检测,并利用免疫荧光、单细胞测序、RNA Scope、CO染色、形态学分析等手段对109种AAV病毒的表达效率和靶向特异性进行了系统评估,最终筛选并鉴定出针对谷氨酸能、GABA能神经元和胶质细胞具有特异性靶向能力的增强子。
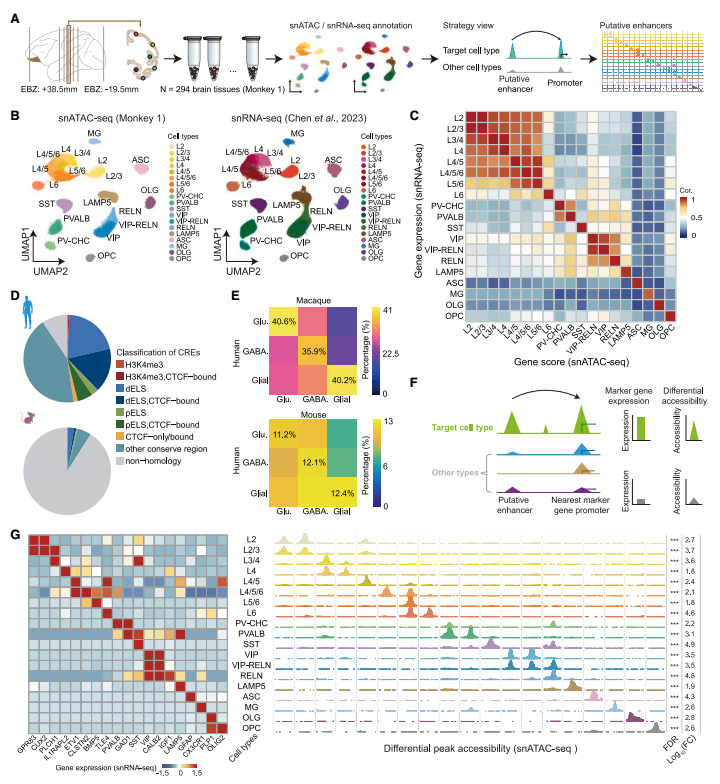
特异性靶向猕猴大脑不同层兴奋性神经元:PrExE13靶向 L2/3 神经元,PrExE31靶向 L4 神经元,PrExE37靶向 L5 神经元,PrExE58靶向 L6 神经元。
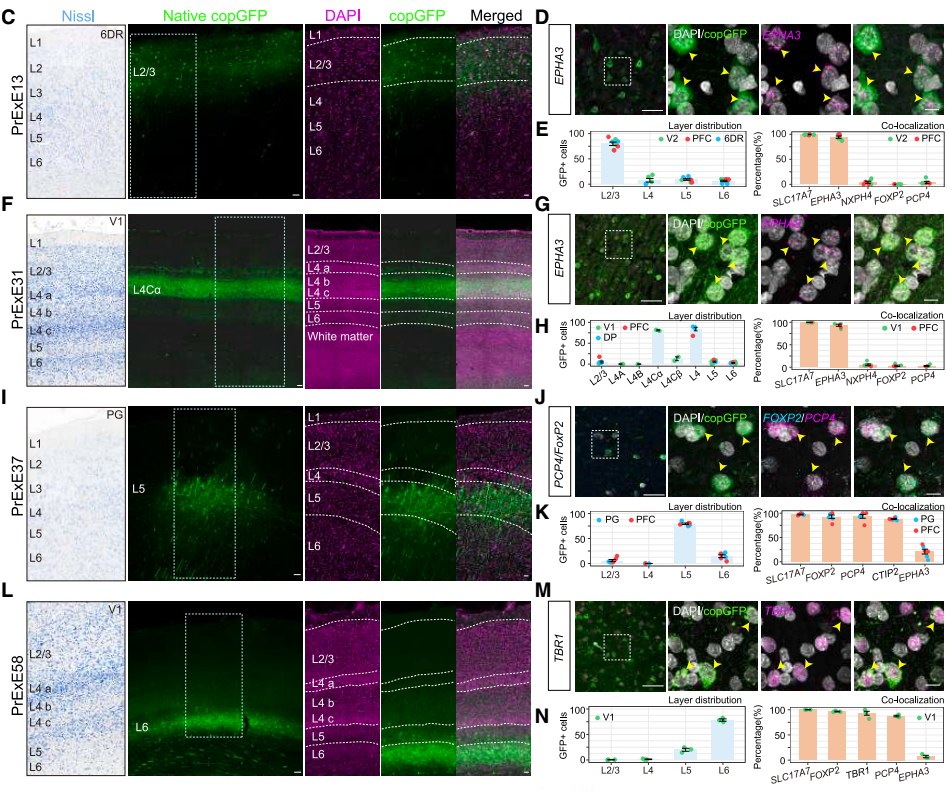
特异性靶向猕猴大脑皮层GABA能神经元:PrIn3靶向 PV +中间能神经元,PrIn6和 PrIn7靶向 SST +中间能神经元,PrIn12靶向 VIP +中间能神经元。
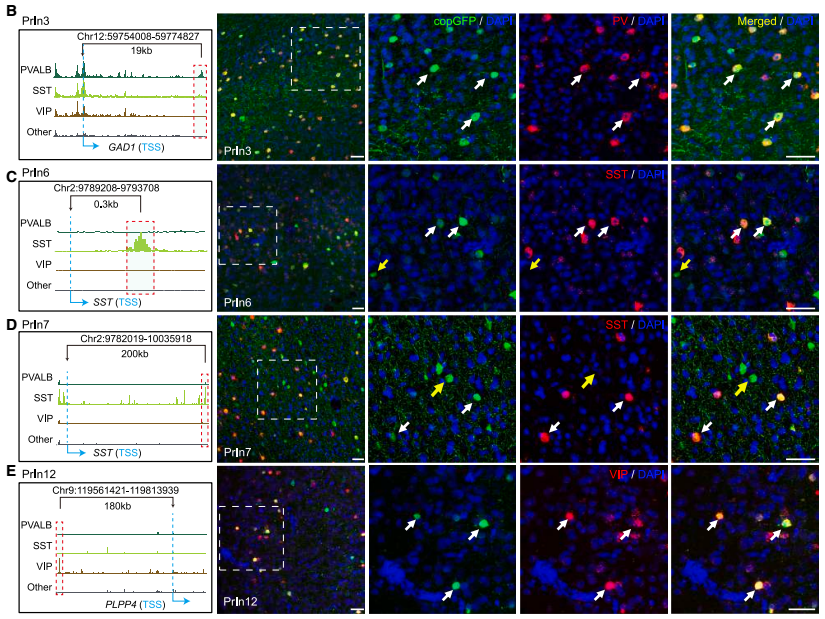
特异性靶向猕猴大脑皮层胶质细胞:PrASC2 靶向星形胶质细胞,PrOLG1和PrOLG2靶向少突胶质细胞
接下来,研究团队比较了猕猴、小鼠和人类大脑中的增强子序列差异, 发现部分增强子具有跨物种序列保守性与功能保守性,如猕猴GABA能神经元和胶质细胞增强子可在小鼠中靶向标记同样的抑制性神经元及胶质细胞;然而,针对,猕猴大脑不同层谷氨酸能神经元增强子在小鼠中未实现同等效力的靶向标记,这表明大脑顺式调控元件存在进化差异。这一结果也提示,研究团队发现的增强子元件更可能在人类中发挥相似的靶向功能,具有潜在临床价值。
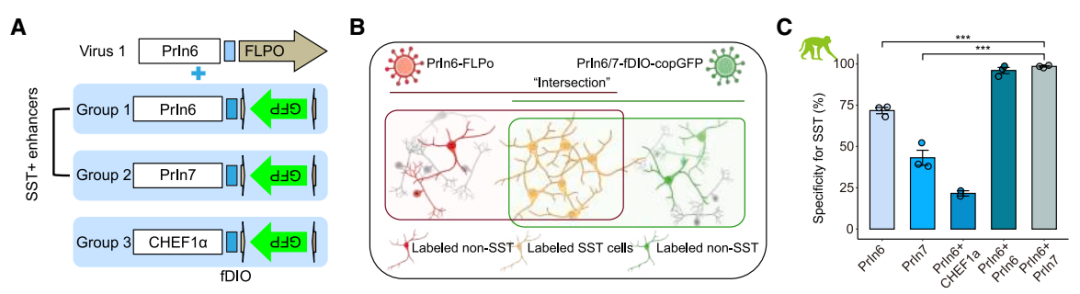
为进一步提高增强子标记特异性,研究团队还开发了基于重组酶(FRT/Flpo)的双增强子正交策略。如针对SST+神经元靶向,选择PrIn6和 PrIn7这两个增强子,分别测试三组双AAV载体系统:1、使用相同SST+神经元增强子:AAV-PrIn6-FLPo 和AAV-PrIn6-fDIO-copGFP;2、使用两个不同SST+神经元增强子:AAV-PrIn6-FLPo 和AAV-PrIn7-fDIO-copGFP;3、使用一种SST增强子和一个广谱启动子:AAV-PrIn6-FLPo 和AAV- CHEF1α-fDIO-copGFP,结果显示,特异性靶向SST+神经元分别为96%、98% 和 21%,提示了借助该策略可以极大提高特异性靶向,且该方法可广泛应用于猕猴和小鼠中。
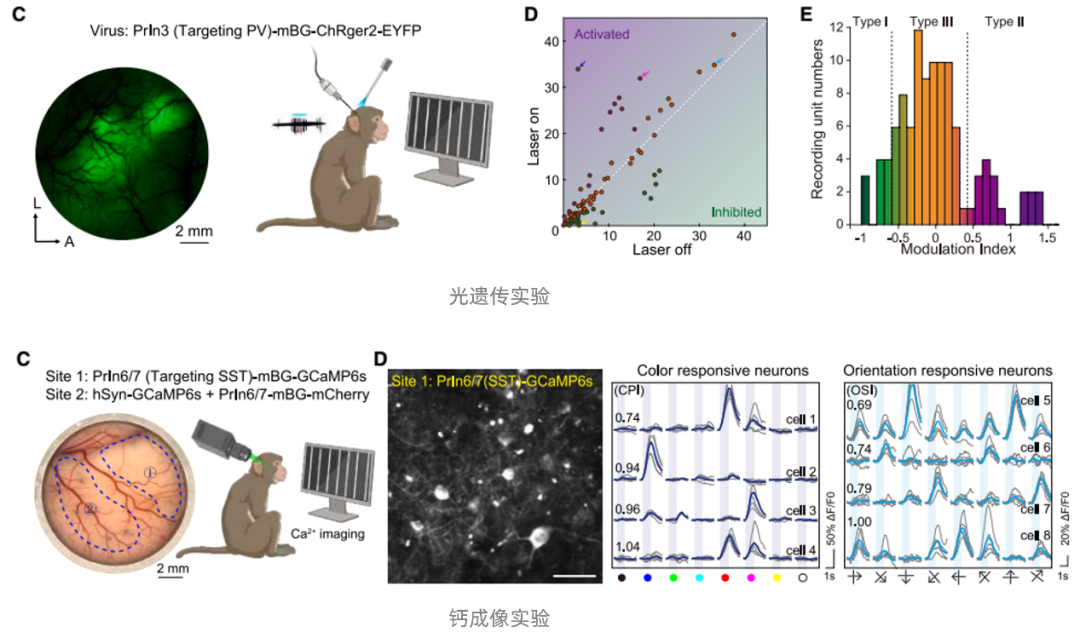
基于上述研究,研究团队在猕猴初级视觉皮层(primary visual cortex, V1)开展了细胞类型特异性光遗传和钙成像实验,如在猕猴V1注射AAV-PrIn3-ChRger2,实现了对PV+中间能神经元的特异性光遗传调控,初步探究了PV+中间能神经元的激活对局部微环路的影响;注射AAV-PrIn6/7-GCaMP6s,实现了对SST+中间能神经元活动的特异性观察,揭示了其在不同视觉信息刺激下的发放模式。最后研究团队利用上述特异性增强子构建了包含112种AAV载体的工具集,打造了“即插即用”的灵长类脑研究工具包,该工具包可以像“开关”一样,在特定细胞类型中表达任何感兴趣的基因(荧光蛋白、光敏蛋白、化学遗传工具、钙指示剂等),支持在灵长类动物中实现9种主要细胞类型的特异性标记、结构解析、靶向活性操纵与动态观测。
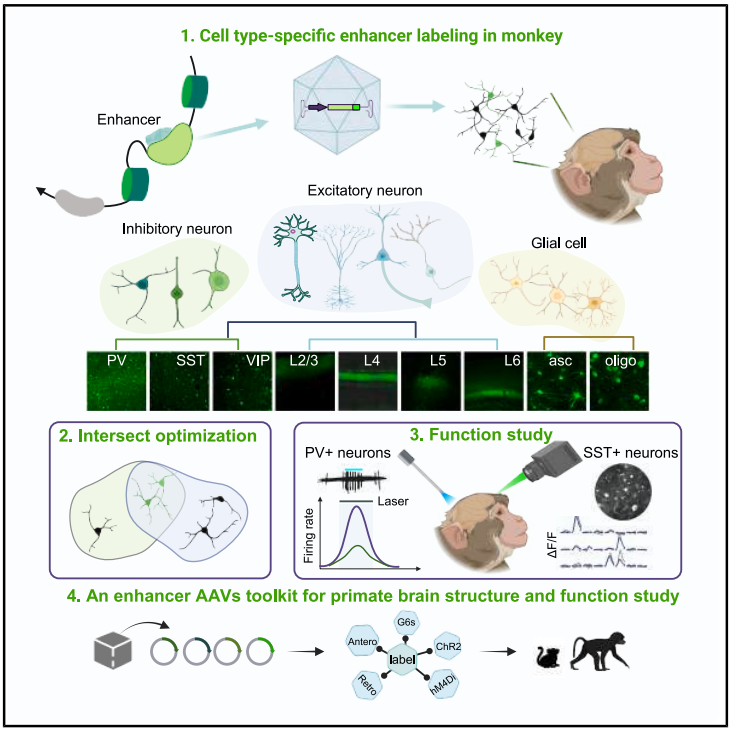
综上,该研究聚焦灵长类脑科学研究的迫切需求,利用脑智卓越中心在灵长类脑图谱研究的已有基础,搭建了包含数据处理、基因工程、探针改造、精细颅外科手术、生物工程、行为训练、电生理记录、光遗传调控、钙成像观测的学科交叉团队和研究体系,系统性地建立了灵长类大脑神经细胞类型特异性标记、神经活性调控及观测的工具集。该研究突破了传统转基因策略的局限,为深入探索灵长类脑结构、解析脑认知原理以及未来实现脑疾病的精准靶向治疗提供了完整且强大的分子遗传工具库,是链接脑结构图谱和脑功能图谱的关键桥梁,标志着灵长类脑科学进入了精准细胞类型研究新阶段。
中国科学院脑智卓越创新中心/上海脑科学与类脑研究中心刘真研究员、脑智卓越创新中心孙怡迪研究员、临港实验室李昊研究员为该论文的共同通讯作者。刘真研究组博士研究生李灵、陆登宇、研究助理傅吉强、临港实验室/上海科技大学研究生黄奕铭为该论文并列第一作者。中国科学院脑智卓越中心蒲慕明研究员、刘赐融研究员、王立娜高级实验师、李超博士、陈哲远博士、廖海欧博士、李莉高级实验师、顾天越、刘合安、唐儆、颜嘉琪,临港实验室李澄宇研究员、冷向晴、张家琪,上海科技大学何芳,华大基因刘龙奇研究员,福建医科大学黄华品教授、吴路燕也参与了本研究并提供了重要帮助。本研究得到了中国科学院脑智卓越创新中心光学成像平台、实验鼠房、实验猴房、分子细胞平台、非人灵长类研究平台、全脑介观神经联接图谱研究平台(非人灵长类)及单细胞分型平台的支持。该研究获得国家科技创新2030重大专项、科技部重点研发计划、国家自然科学基金、上海市重点专项、临港实验室重点任务、中国科学院上海分院青年攀登计划项目的资助。
和元助力
和元生物有幸为研究者提供实验中使用的AAV载体,以实际行动助力脑科学研究!
业务咨询








