和元生物技术(上海)股份有限公司品牌商
14 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
公司新闻/正文
Nat Commun. | 西安交大李小军团队解密耳蜗“再生指挥官”,JAG1如何一边“刹车”一边“加油”调控毛细胞再生
1019 人阅读发布时间:2025-09-09 13:10
内耳耳蜗毛细胞(Hair cells, HCs)是听觉必需的主要功能细胞,在哺乳动物中没有再生能力,现实生活中,遗传因素、噪音、耳毒性药物或衰老,可通过损害HCs引起不同程度的听力损伤,在任何一种情况下,这些损害对于没有再生能力的耳蜗毛细胞的哺乳动物都是不可逆转的。内耳另一类重要细胞—支持细胞(Supporting Cells, SCs)对于维持耳蜗结构和毛细胞正常功能至关重要,目前的研究认为支持细胞具有转分化为HC样细胞的潜力。
Notch信号通路是一条在进化中高度保守的,决定细胞命运的重要信号通路之一,其在听觉器官发育过程中具有两种截然不同的作用,低强度Notch信号维持前体细胞特性;高强度信号会抑制SCs向HCs转分化,这两种不同的模式依赖于不同的Notch配体。Notch配体Jagged1(JAG1)在内耳耳蜗中表达,并参与维持前体细胞状态。然而 JAG1在SCs转分化HC过程中的的具体机制尚不明确。
2025年9月1日,西安交通大学李小军教授和美国约翰·霍普金斯大学的 Angelika Doetzlhofer 团队在Nature Communications上发表了题为“The Notch ligand Jagged1 plays a dual role in cochlear hair cell regeneration”的新研究成果。该研究基于新生鼠耳蜗上皮类器官体系,聚焦JAG1在毛细胞再生中的功能,发现JAG1的双重调控机制:一方面JAG1抑制毛细胞命运稳定;另一方面JAG1参与维持支持细胞前体细胞特性,并解析JAG1发挥功能的分子机制,其通过Notch1/2受体激活 PI3K-Akt-mTOR 信号通路,维持细胞增殖、代谢及前体细胞特性,外源性JAG1可促进成熟耳蜗SCs再生潜能。这些发现为开发基于JAG1/Notch信号调控的耳聋再生疗法提供新的理论依据。

结 果
JAG1在毛细胞再生过程中具有双重作用
首先,为了解Jag1对于耳蜗支持细胞(supporting cells, SCs)和SC样Kölliker 细胞(KCs)有丝分裂与再生潜能,研究团队建立耳蜗类器官培养体系,从P2 TetO-Cre; R26rtTA*M2/+; Jag1f/f小鼠(Jag1条件性敲除小鼠,Jag1 cKO)中分离耳蜗上皮细胞,在含多四环素(dox)条件下培养类器官(图1b)。分子生物学结果显示,Jag1 cKO 类器官中细胞内JAG1蛋白含量显著降低(图1c-d)。培养7天后,发现Jag1 cKO 类器官形成效率和直径大小下降(图1e-j),提示了Jag1缺失对耳蜗类器官的形成和生长具有抑制作用。
进一步,研究者借助p27-GFP转基因(在SCs中高表达,KCs中微弱表达)和流式细胞分选技术(FACS)进行细胞特异性分析,发现SCs(p27-GFP⁽⁺⁾)依赖Jag1实现类器官形成与生长,而KCs(p27-GFP⁽⁻⁾)仅依赖Jag1维持类器官生长,不依赖其进行类器官形成(图1k-n)。
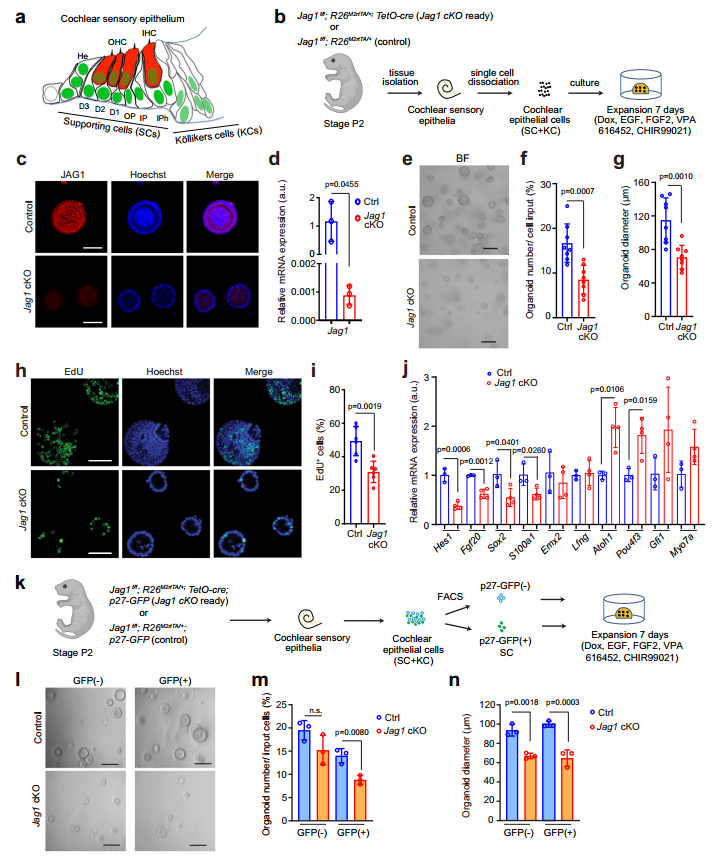
图1 Jag1缺失对P2耳蜗类器官的形成和生长具有抑制作用
先前研究发现,抑制Notch信号可刺激小鼠受损耳蜗中未成熟SCs及部分成熟SCs向HCs转分化。基于此,为明确Jag1缺失是否会提高耳蜗类器官中HC形成速度,研究团队培养Jag1 cKO 类器官,11天后更换分化培养基以诱导HC形成(图2a)。结果显示,Jag1 cKO 类器官HCs特异性基因(Myo7a、Pou4f3)表达显著上升,Myo7a⁺SOX2⁺HCs(新生毛细胞)占比达 20%,而对照组仅零星分布(图2b-d),提示Jag1缺失促进耳蜗毛细胞转分化。同时,细胞特异性分析显示 p27-GFP⁽⁺⁾ SCs Jag1 cKO 类器官中HCs早期特异性基因(Atoh1、Pou4f3、Gfi1)表达显著升高,免疫染色显示其新生毛细胞占比显著增加,且出现中大型毛细胞簇,而p27-GFP⁽⁻⁾ KCs Jag1 cKO 类器官中相关基因仅轻微上升(图2e-i),提示了SCs转分化为HCs受 JAG1的强抑制调控。
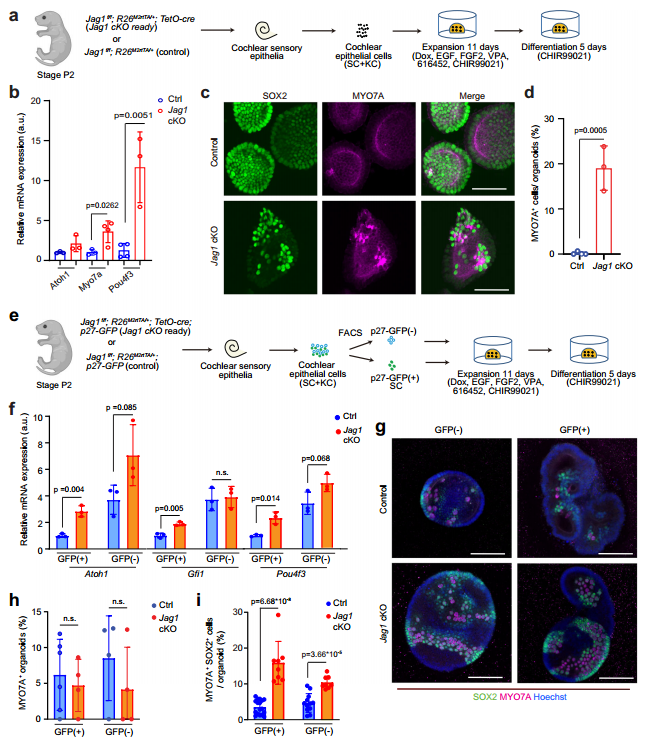
图2 Jag1缺失会促进SCs转分化为HC
JAG1调控分子机制
随后,作者借助转录组学分析(RNA-seq)发现,Notch信号效应基因(Hes1、Hey1、HeyL、Sox2)、促生长基因以及调节细胞代谢相关基因显著下调;毛细胞特异性基因(Tunar、Pou4f3、Scx)和齿间细胞相关基因显著上调。此外,富集分析结果提示了Jag1缺失会破坏耳蜗SCs和KCs中的PI3K-Akt-mTOR 信号传导(图3)。
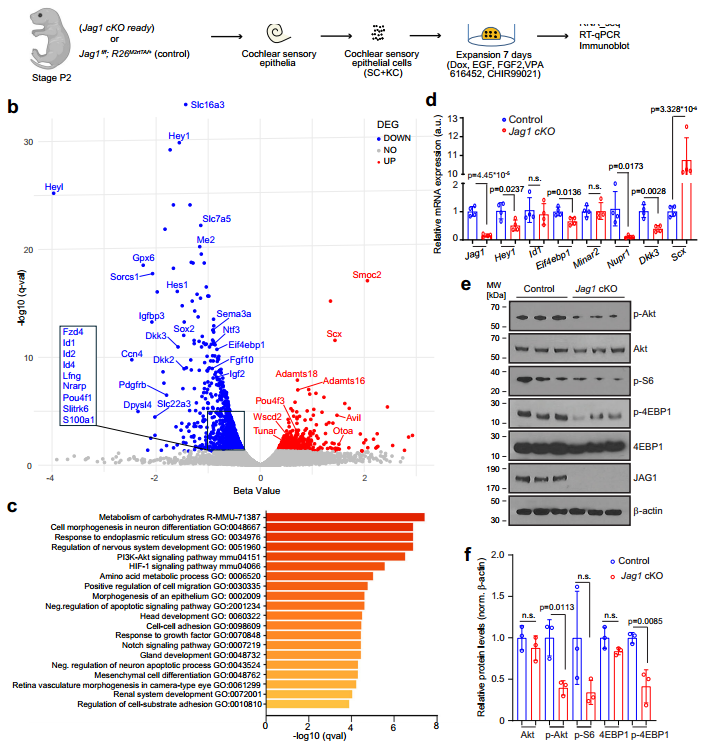
图3 Jag1缺失会降低祖细胞和SCs特异性基因表达,并减弱PI3K-Akt-mTOR信号传导
为验证这一假设,探究团队继续做机制研究。结果发现,Jag1 cKO 类器官中PI3K-Akt-mTOR 信号通路关键蛋白(p-Akt、p-4EBP1)的磷酸化水平显著降低,表明JAG1是该通路的正向调控因子。在Jag1 cKO 类器官中加入不同浓度JAG1-Fc肽(可激活Notch信号)或在野生型类器官中借助慢病毒载体过表达JAG1后,Jag1 cKO 类器官和野生型类器官的形成效率、直径大小及p-Akt、p-4EBP1蛋白水平均显著增加。进一步验证了JAG1对该信号通路的调控作用(图4)。
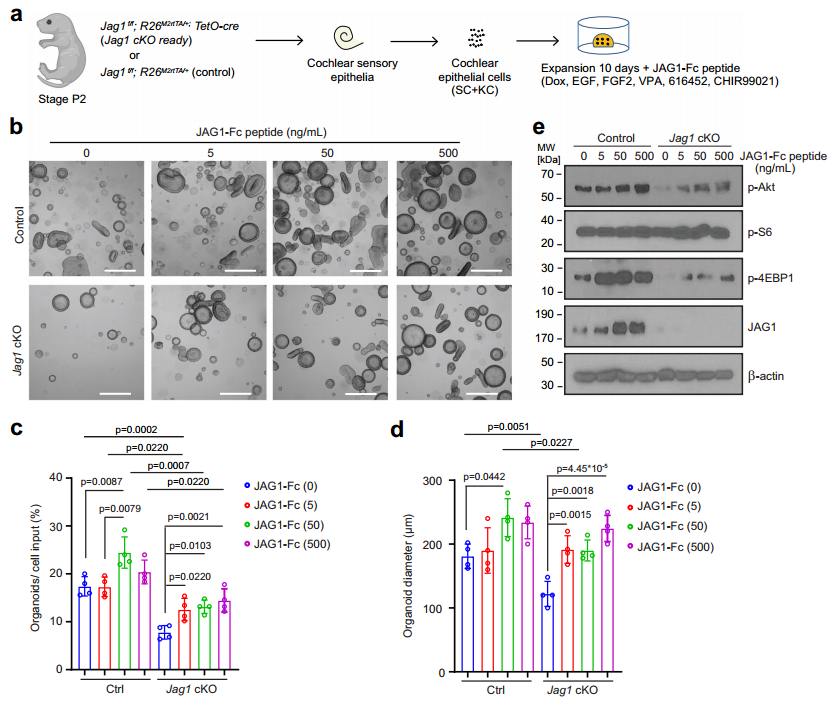
图4 JAG1促进Jag1 cKO 类器官生长及PI3K-Akt-mTOR信号通路恢复
Notch调控机制具有受体特异
此外,作者分离P2野生鼠耳蜗上皮细胞(SCs和KCs)培养类器官,并借助慢病毒载体过表达Notch胞内结构域(pLVX-TetOne-EGFP-NICD),在不同剂量DOX(无dox、低剂量、高剂量)条件下观察类器官形成和大小(图5a)。结果发现,低剂量dox可显著提升类器官大小和生长速度,高剂量dox则对类器官的形成和生长具有不利影响(图5b-d)。同时,作者进行双向验证,借助Notch信号抑制剂(LY411575)亦发现类似现象,即低水平的Notch受体信号促进耳蜗类器官的形成和生长,而高水平的Notch受体信号则具有抑制作用(图5)。
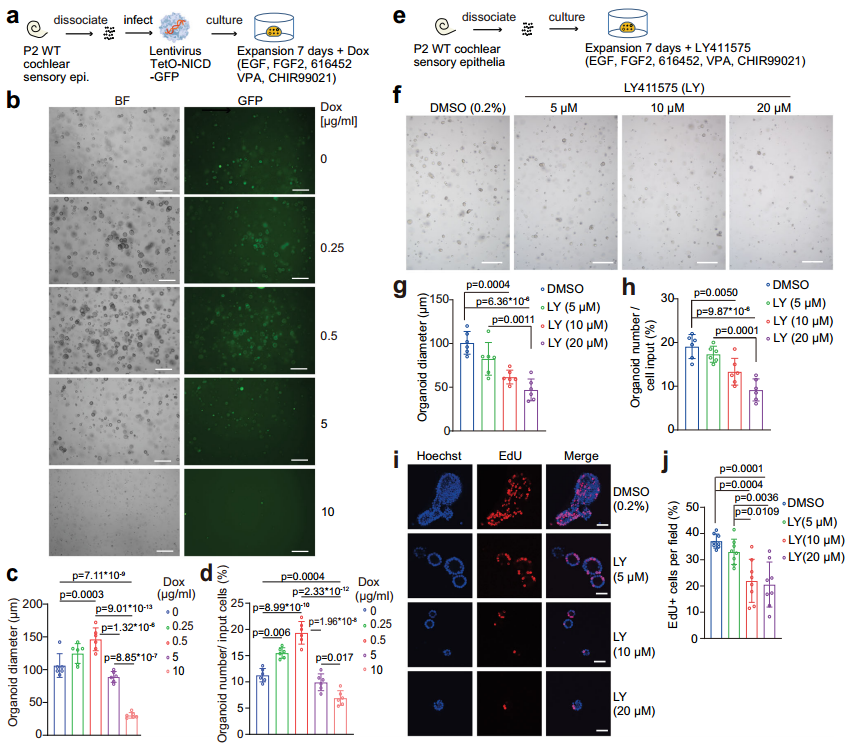
图5 低水平Notch受体信号促进耳蜗类器官的形成和生长
出生后早期耳蜗SCs和KCs共表达Notch1、Notch2和Notch3受体,为验证哪种受体介导JAG1对耳蜗类器官促生长作用,研究团队分别分离培养Notch1、Notch2和Notch3缺陷的P2鼠耳蜗类器官,发现Notch1/2 双敲(Notch1/2 DKO,P2 Notch1fl/fl;Notch2fl/fl鼠分离耳蜗上皮细胞,借助LV-Cre感染细胞)类器官中,类器官形成速度、直径大小显著下降,p-Akt、p-4EBP1 蛋白水平显著降低,提示了Notch1 和 Notch2 在调控耳蜗PI3K-Akt-mTOR 信号中具有冗余功能(图6)。
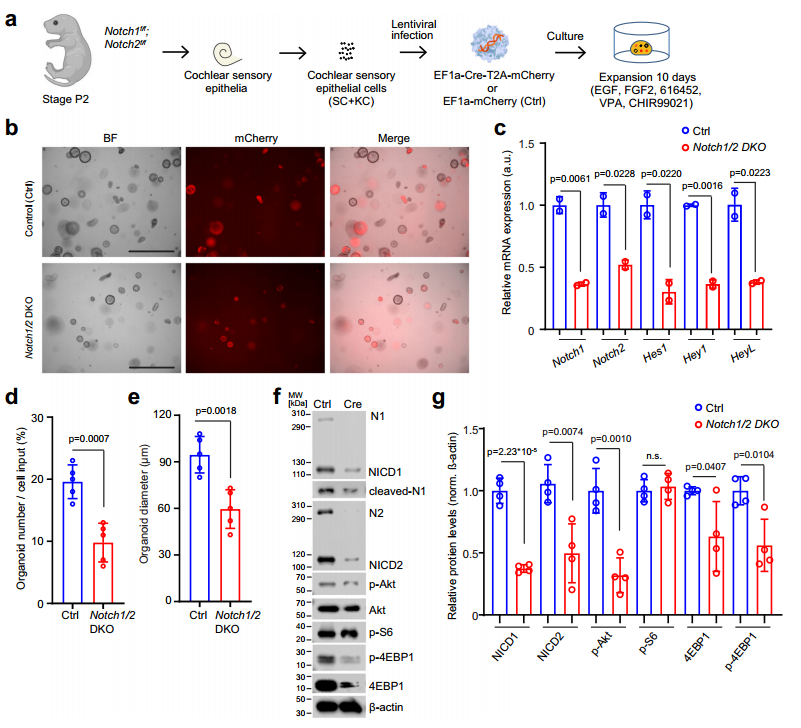
图6 Notch1和Notch2缺失会减少耳蜗类器官的形成和生长,并减弱PI3K-Akt-mTOR 信号传导
外源性JAG1可促进SCs再生潜力
在耳蜗成熟过程中,SCs转分化HCs能力下降,Notch1信号强度降低。因此,为表征耳蜗成熟过程中Jag1表达量动态变化,作者借助FACS从P1、P5、P13 Lfng-GFP小鼠分离SCs,并分析Jag1表达量发现,Jag1 mRNA水平随着耳蜗成熟显著动态下调(图7a,b)。在P5使用JAG1-Fc肽处理可促进SCs增殖及新生HCs数量增加,提升P5(开始成熟)耳蜗SCs转分化HCs能力(图7c-g)。然而,借助雷帕霉素(mTORC1抑制剂)处理可降低JAG1-Fc肽诱导产生的新生毛细胞数量(图7h-j),这提示了JAG1通过激活mTOR 信号促进毛细胞形成。
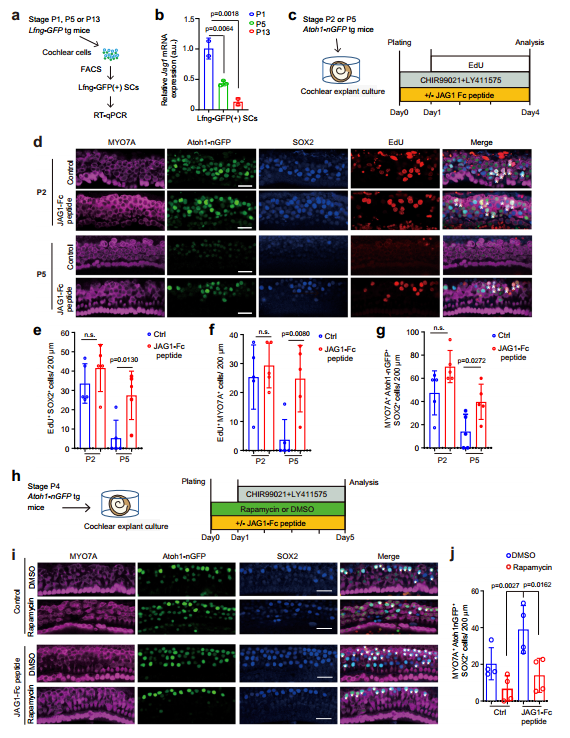
图7 JAG1-Fc肽通过激活mTOR 信号促进毛细胞形成
最后,作者进行体内验证。早期研究发现,在围产期,耳蜗SCs中ATOH1过表达可促进SCs转分化为HCs,但从P7/P8开始,SCs再生能力下降。为明确JAG1是否可以促进ATOH1诱导SC-HC转分化,研究者借助AAV过表达ATOH1(AAVie-ATOH1-EGFP)与JAG1-Fc肽经圆窗膜注射(RWM)共注射P7小鼠耳蜗,在P17进行检测,结果显示,耳蜗顶转新生毛细胞梳理显著提高,提示了外源性JAG1可增强ATOH1诱导的SCs转分化能力。
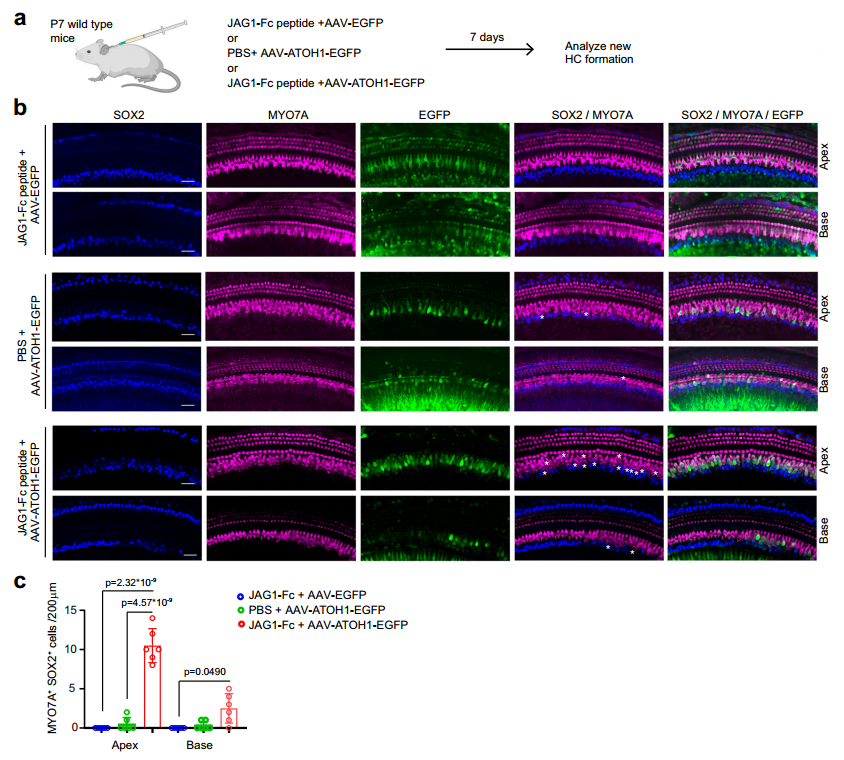
图8 JAG1促进ATOH1诱导的SCs转分化HCs
结 论
文中,作者构建多种耳蜗类器官培养体系,结合分子生物学、谱系追踪、FACS、RNA-Seq等多种技术手段,阐明JAG1在毛细胞再生过程中的双重作用机制:JAG1/Notch1/2通过调控PI3K-Akt-mTOR 信号通路维持支持细胞前体细胞特性,同时参与毛细胞命运抑制的分子机制。进一步研究发现,JAG1表达随耳蜗成熟显著下降,外源性JAG1-Fc肽可通过激活mTOR 信号,恢复成熟耳蜗支持细胞转分化的能力,促进毛细胞再生。该研究揭示了JAG1在毛细胞再生中的核心机制,为耳聋的再生疗法提供了新靶点和理论依据。
和元助力
和元生物有幸为研究者提供实验中使用的AAV载体,以实际行动助力基础科学研究!
业务咨询








