和元生物技术(上海)股份有限公司品牌商
13 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
公司新闻/正文
Cell stem cell(IF20.3) | 人气道粘膜下腺类器官揭示呼吸道感染与炎症新机制
584 人阅读发布时间:2025-08-12 15:57
人类气道由表面气道上皮(surface airway epithelium, SAE) 和深层的黏膜下腺体(submucosal glands, SMGs) 组成。这些腺体持续分泌黏液与抗菌因子,调控着呼吸道的微环境、黏液动力与免疫响应。然而,它们的生物学功能、细胞组成及其在疾病中的作用仍知之甚少。
2025 年 7 月 3 日,中国科学院分子细胞科学卓越创新中心的林琳研究员与荷兰皇家艺术与科学院 Hubrecht 研究所的 Hans Clevers 教授团队合作在Cell stem cell(IF20.3)上发表了题为“Human airway submucosal gland organoids to study respiratory inflammation and infection”的研究成果。首次成功建立人气道粘膜下腺(SMG)类器官,并结合单细胞转录组分析、基因编辑与病毒感染模型,系统性描绘了区别于SAE的SMG 上皮的细胞异质性、干性潜能和炎症-病毒刺激的应答模式。这项工作不仅为研究人呼吸道腺体的生理与病理状态提供了全新模型,也提示其在呼吸道再生与病毒感染中的关键角色。
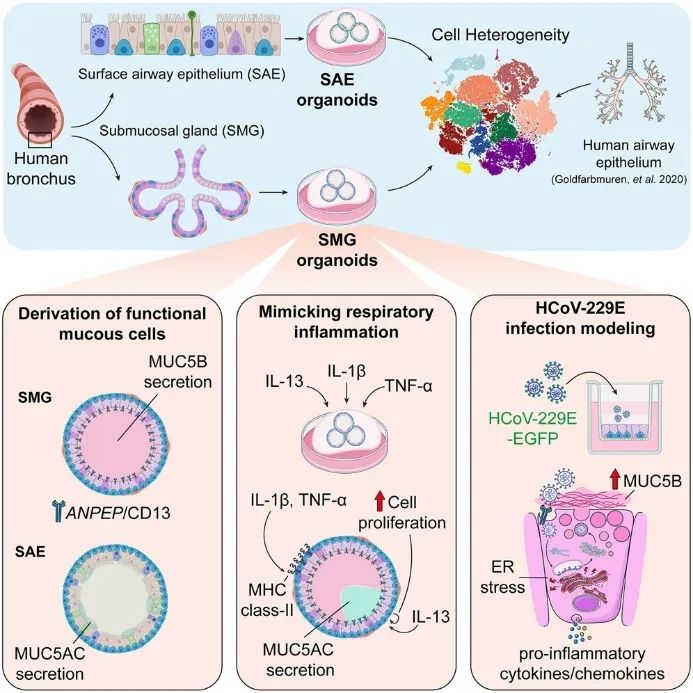
研究结果
人支气管SMG类器官的建立及表征
通过两步酶消化从支气管中去除 SAE(图1 A),从粘膜下肌纤维中释放 SMG。然后将 SAE和 SMG 腺簇分别在定制培养基中培养,建立了 SAE 和 SMG 类器官(图 1 B-C)。类器官表现出明显的分化细胞类型,SMG 类器官含有 PAS+ 和 MUC5B+ 粘液细胞,而 SAE 类器官主要由基底细胞、纤毛细胞和较少见的产粘液细胞组成(图 1 D)。与组织表达一致,SMG主要表达 MUC5B,而 SAE同时表达 MUC5AC 和 MUC5B(图 1 E)。
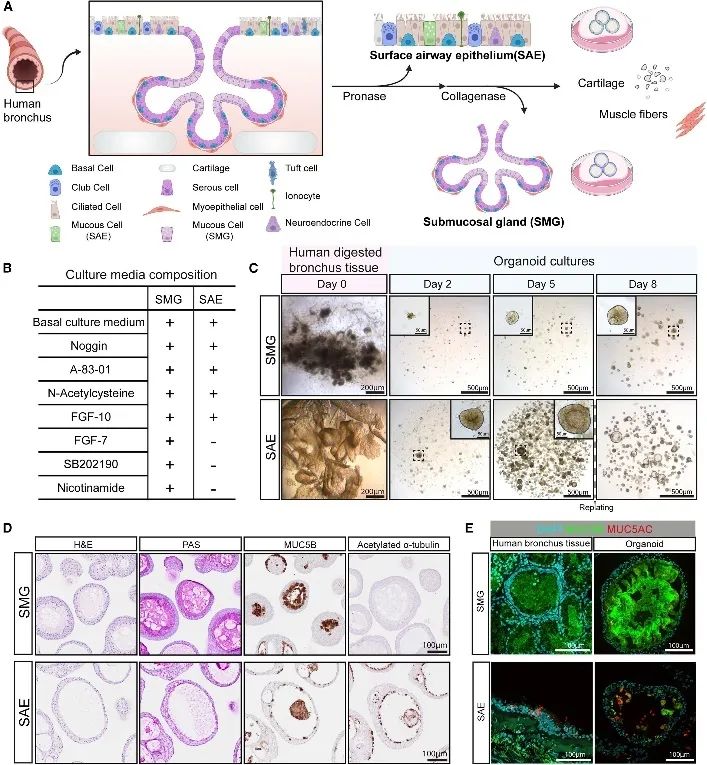
图1人支气管SMG类器官的建立及表征
SMG和SAE类器官的单细胞表达特征
为了将 SMG 和 SAE 类器官与其组织进行比较,对SMG 和 SAE 类器官进行了单细胞 RNA 测序 (scRNA-seq),并与之前发表的人气道上皮组织数据集整合。获得了 1315 个 SMG 类器官细胞、1120 个 SAE 类器官细胞和 36,248 个组织细胞(图 2 A-C)。SMG 类器官由 SMG 基底细胞( KRT14+和G0S2+)和 SMG 分泌细胞(MUC5B+和DMBT1+)组成。SAE 基底细胞(TP63+和MMP10+)、SAE 分泌细胞(MUC5AC+和CEACAM5+)和棒状细胞(SCGB1A1+)主要在 SAE 类器官中发现(图 2 D)。
SMG 的一个定义特征是 MEC 的存在。MEC 表达平滑肌标志物,如α-SMA 和肌球蛋白,从而使其具有收缩功能,能够将腺体分泌物排出到气道腔中。基于MEC 细胞评分,在 SMG 基底细胞簇内鉴定出一小部分 MEC 群,包括2.2 %的SMG 类器官细胞和 3.1% 的 SMG 组织细胞(图2 E)。相比之下,少数被分配到 SMG 基底簇的 SAE 衍生基底细胞(0.98%)仅表达基底细胞(KRT14和KRT5)和细胞间粘附(FHOD3和LAMA1)标志物(图 2 F-G)。接下来,解析SMG的分泌功能,确定ANPEP(CD13)是SMG分泌细胞中高度富集的表面标志物之一(图2 H)。CD13定位于SMG组织和类器官的顶端表面(图2 I)。总之,这些分析证实了 SMG 和 SAE 类器官模型准确复制了各自组织类型的细胞异质性,ANPEP/CD13 被确定为 SMG 分泌细胞的特异性标记物。
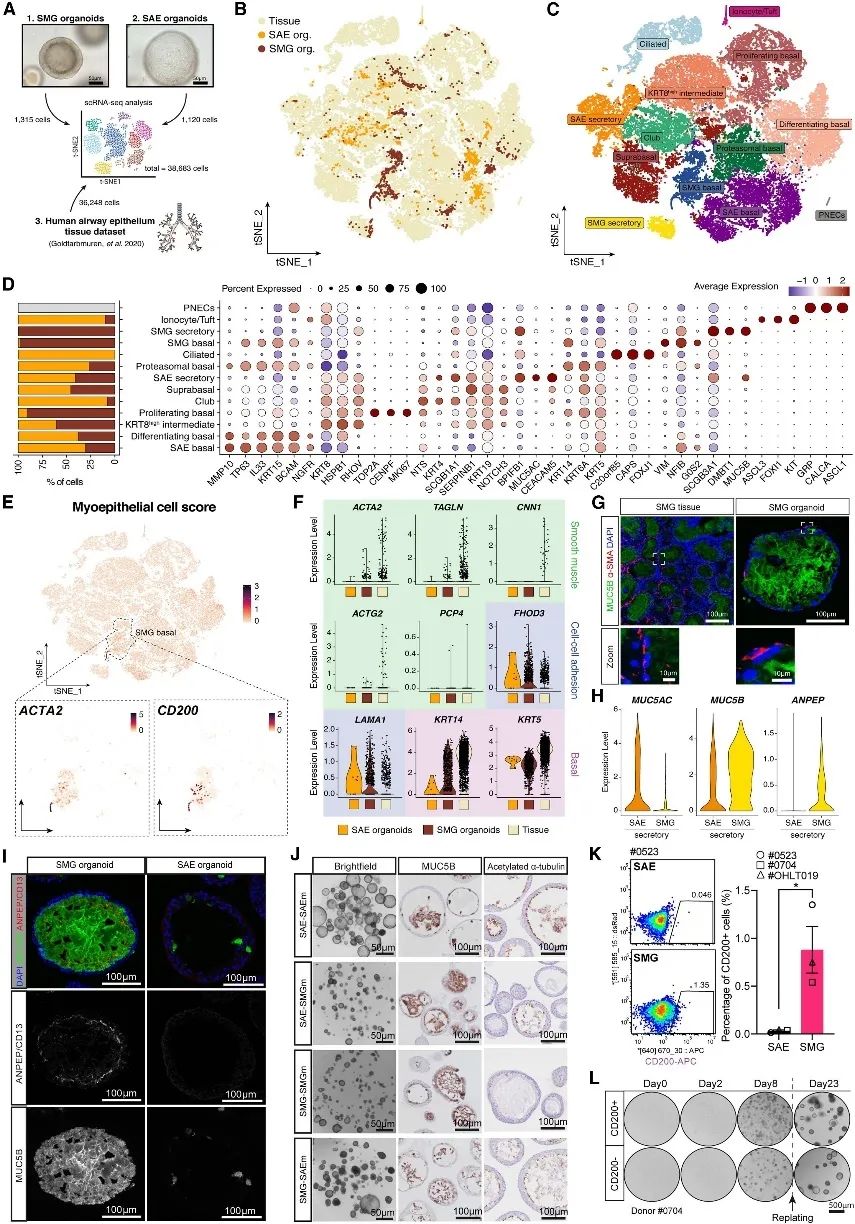
图2 SMG 类器官、SAE 类器官和原发性气道组织的scRNA-seq 图谱
解析SMG类器官的炎症反应特征
IL-1β和TNF-α是关键的促炎细胞因子,在气道炎症反应中起着关键作用 (图 3 A )。将 SMG 类器官暴露于 IL-1β、TNF-α 或 IL-13,以阐明 SMG 分泌细胞中的独特反应。用炎症因子治疗 7 天后,IL-1β 和 IL-13 显著降低了 CD13 +细胞的百分比(图 3B )。此外,对分选的CD13+和 CD13-细胞进行bulk RNA 测序,证实了 SMG 粘液细胞标志物(MUC5B、BPIFB1、WFDC2、AGR2和PIGR)和糖基化相关通路在 CD13 +细胞中富集。IL-1β 和 TNF-α 共同诱导先天免疫和抗原呈递途径(图 3 D),且特异性诱导MHC II 类基因表达(图 3 E-F)。值得注意的是,IL-13 显着抑制了 CD13 + SMG 细胞中的 MUC5B 表达,同时增强了 MUC5AC 表达(图 3G-H)。这些结果表明,将 SMG 类器官暴露于 IL-1β、TNF-α、IL-13 等细胞因子,引发了不同的炎症转录反应,如 IL-1β 和 TNF-α 诱导 MHC II 类基因表达,IL-13 促进细胞增殖并改变粘蛋白表达等。
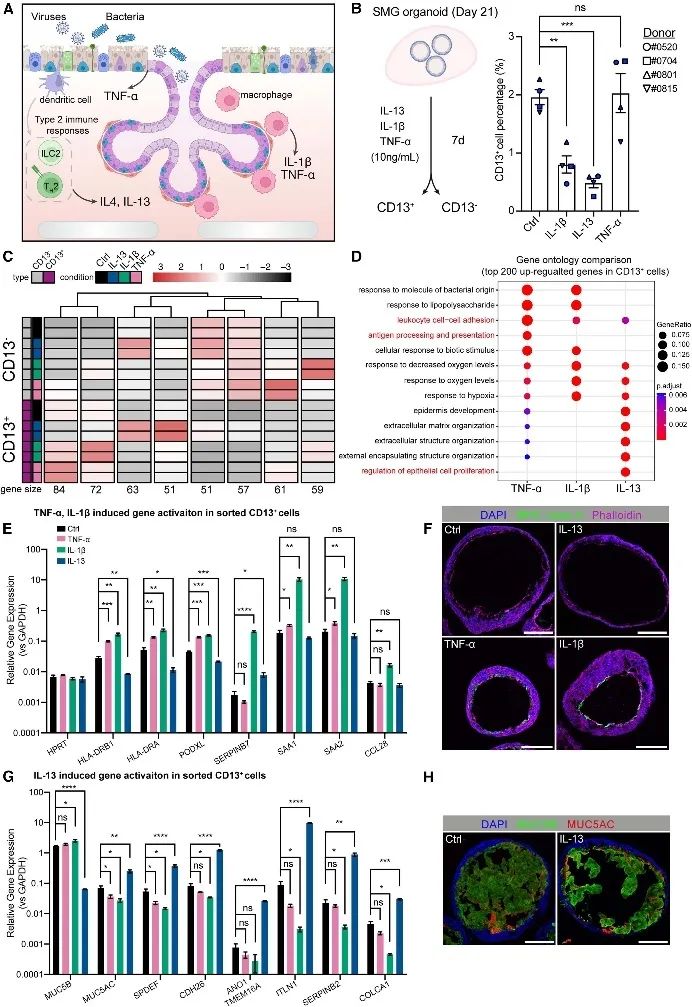
图3 SMG类器官的呼吸道炎症反应特征
HCoV-229E 主要攻击 SMG 分泌细胞并引起细胞应激
呼吸道病毒感染是急性 COPD发作的主要原因。在本研究中发现人类 α 冠状病毒 229E (HCoV-229E)的已知受体ANPEP/CD13主要在 SMG 的顶端表面表达。进一步发现HCoV-229E 主要感染 SMG的 CD13 +细胞(图 4C-D)。接下来,对来自三个独立供体的受感染 (CD13 + EGFP + ) SMG 细胞进行了bulk RNA 测序 (图 4 E)。正如预期,HCoV-229E 感染影响了干扰素反应基因 ( IFIT、OAS和ISG基因家族)、趋化因子 ( CXCL9、CXCL10和CXCL11 ) 和抗病毒宿主因子 ( BATF2、SAMD9和STAT1 ) 的表达;且参与 ATP 代谢基因受到显著抑制 (图 4 F )。有趣的是,参与内质网 (ER) 应激和未折叠蛋白反应的基因在受感染的细胞中显著上调,包括中枢调节器 ( DDIT3 /CHOP、EIF2AK3 /PERK 和HSPA5 /BiPS),以及热休克蛋白家族基因 (图 4 G )。总体而言,HCoV-229E主要感染 CD13 阳性的 SMG 分泌细胞,感染触发内质网应激(未折叠蛋白反应) 和促炎因子(如IL-6、CXCL8)释放,导致细胞损伤,且感染会增加 MUC5B 和 MUC5AC 的分泌,这可能与慢性阻塞性肺疾病(COPD)急性加重有关。
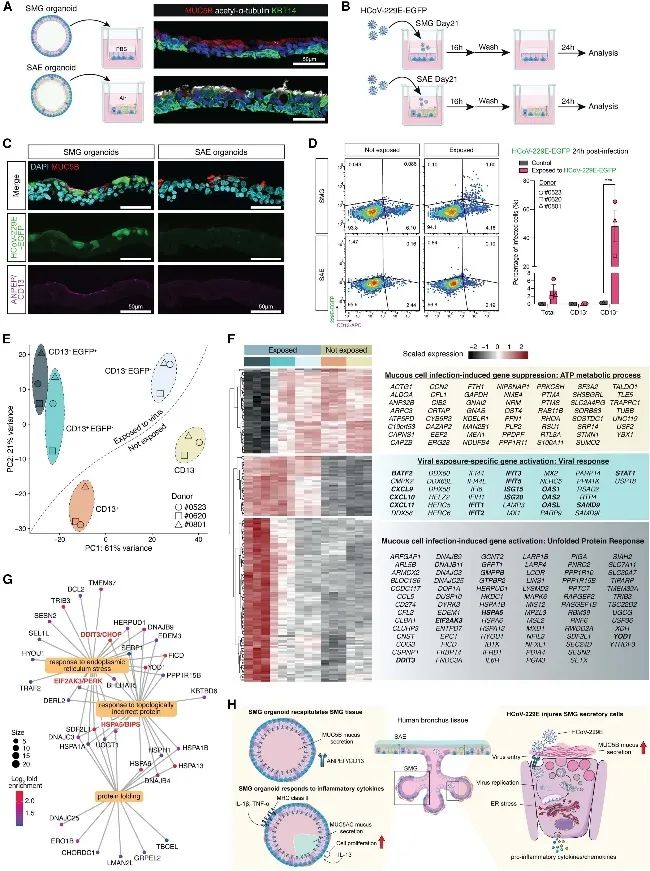
图4 HCoV-229E主要攻击SMG分泌细胞并引起细胞应激
结论
该研究发现的ANPEP/CD13作为黏膜下腺分泌细胞特异性标记物,以及HCoV-229E对CD13阳性细胞的选择性感染,为理解冠状病毒感染的细胞靶向性和病毒驱动的气道损伤机制提供了重要见解。这对于开发针对呼吸道病毒感染的治疗策略具有重要指导意义。







