和元生物技术(上海)股份有限公司品牌商
13 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
公司新闻/正文
【on-target2.0】AAV感染心脏组织 | 血清型·启动子·注射用量 | 一篇就GO了!
335 人阅读发布时间:2025-07-09 10:03
心脏(heart)是动物循环系统中的主要器官,主要功能是推动血液流动,向器官、组织提供充足的血流量,以供应氧和各种营养物质,并带走代谢的终产物,使细胞维持正常的代谢和功能;心脏另有内分泌功能,其分泌的肽类激素可起到调节血压、尿量及人体内水平衡的作用。许多先天性和获得性心脏病的发病机制与心脏的遗传和分子程序的变化密切相关,对于这类心脏疾病的治疗,基于病毒载体的基因疗法具有很大的治疗前景。
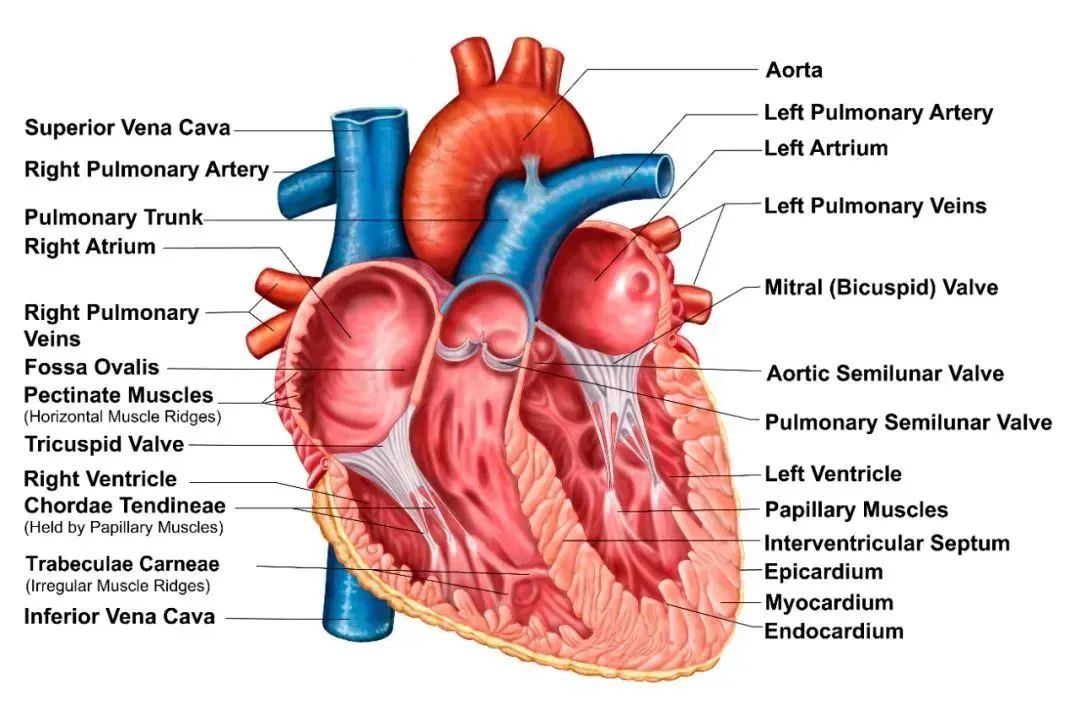
图1:心脏结构
重组腺相关病毒载体(recombinant Adeno-associated virus, rAAV)是表达基因序列的理想载体,具有血清型种类多样、免疫原性低、长期稳定表达基因、宿主范围广等优势,在基因功能研究和基因治疗递送载体中占据主导地位。
01 AAV血清型选择
AAV血清型种类多样,由于AAV衣壳蛋白结构不同,使其具有不同的组织亲嗜性。AAV1、AAV6、AAV8、AAV9等血清型被报道可以高效转导动物心脏,其中AAV9血清型被认为在小鼠心脏基因递送具有更强的优势;AAV6对体外分离培养的心肌细胞的转导效率更高。研究者可根据实验目的、实验设计去选择合适的病毒载体。
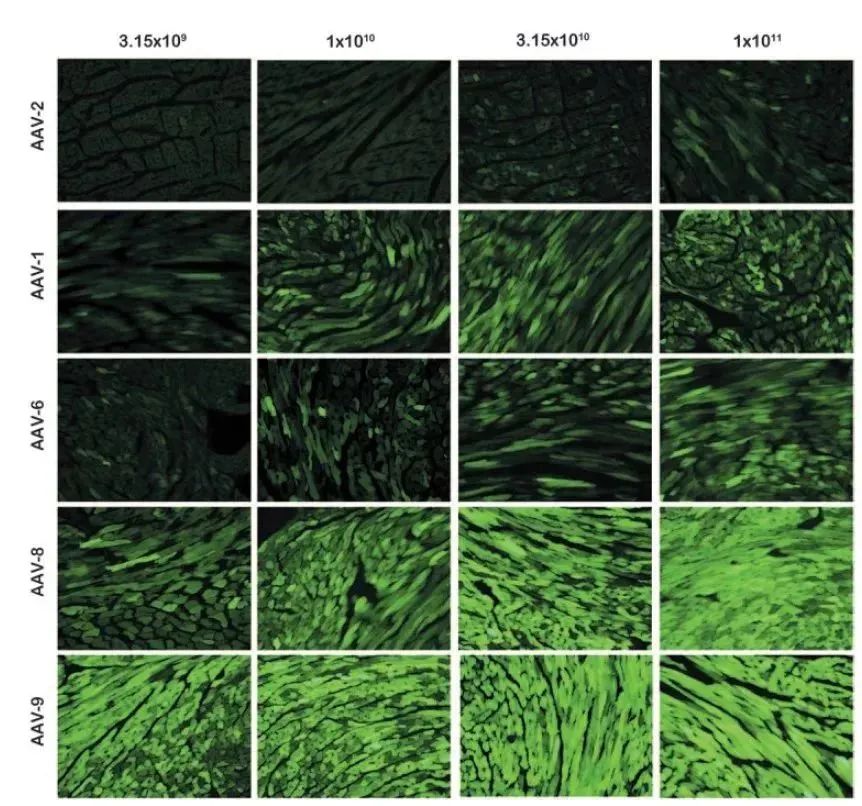
图2:不同血清型感染对心脏转导效率比较(颈静脉注射1周龄小鼠,4周表达结果,PMID: 20703310)
感染效果图

图3:和元生物测试AAV9血清型尾静脉注射感染心脏结果
心脏主要由心肌细胞(cardiomyocytes, CM)组成,理想的心脏基因疗法载体需要高效转导心肌细胞,心肌也是横纹肌的一种。MyoAAV1A血清型可以通过系统注射途径实现高效、特异转导横纹肌。
感染效果图
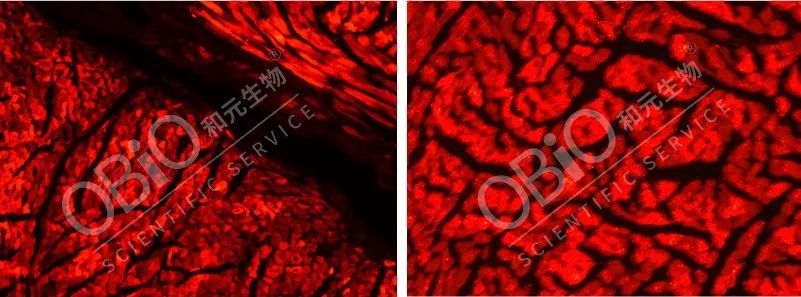
图4:和元生物测试MyoAAV1A血清型尾静脉注射感染横纹肌(心肌切片结果)
心脏中的血管内皮细胞(Vascular endothelial cells, ECs)在心脏生理学和病理生理学中发挥着重要作用。为了探究其中相关基因对心血管疾病的影响,研究人员开发了新型血清型AAV-Vec用以高效感染内皮细胞。
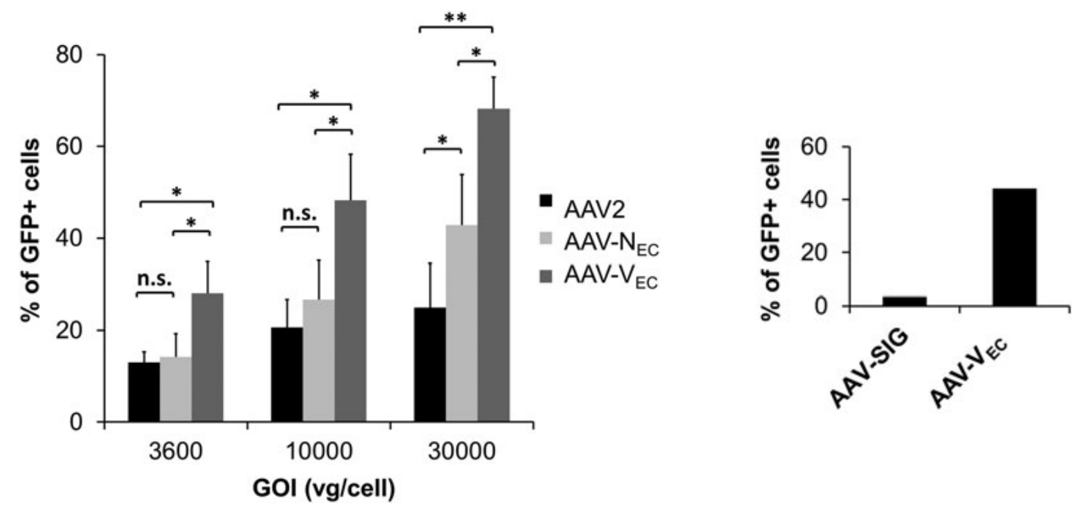
图5: AAV-Vec高效转导血管内皮细胞(PMID: 31407607)
02 启动子选择
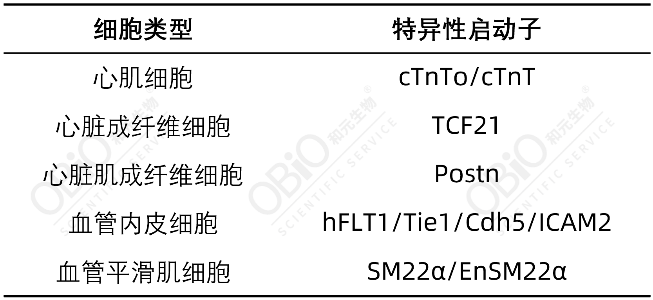
心脏是一个精密的器官,由多种不同类型的细胞构成,它们协同工作以实现泵血功能、维持结构完整性、提供营养和清除废物以及进行电信号传导。前文中提到的心肌细胞是心脏中最主要的细胞类型,通过收缩产生泵血的力量。心脏成纤维细胞(Cardiac fibroblasts, CF)负责产生细胞外基质、组织修复与重塑以及细胞间信号传导。当CF受到特定刺激(如损伤或炎症),就会分化为更活跃的心脏肌成纤维细胞(Cardiac myofibroblasts, CMF),与心力衰竭、心肌梗死等心脏疾病关系密切。此外,心脏中的血管内皮细胞和血管平滑肌细胞(Vascular smooth muscle cells, VSMCs)也是心血管研究领域关注的重点。对于上述不同的细胞类型,和元生物均能提供对应的特异性启动子以实现精准靶向。
表1:心脏相关细胞的特异性启动子
心血管研究利器——AAV-Heart系统
高效血清型+特异启动子的超强组合
AAV-Heart系统是和元产品,高效特异靶向心肌细胞。实验结果显示,尾静脉注射AAV-Heart系统转导心脏比传统的系统更高效,并且几乎不会泄漏到肝脏或骨骼肌中。

图6: AAV-Heart感染效果
03 注射方式及注射剂量
靶向心脏的基因递送方式包括心肌定点注射、静脉注射、冠状动脉注射、皮下注射等,目前针对小鼠心脏基因递送常用的注射方式主要为心肌定点注射和尾静脉注射。
表2:几种常见注射方式比较
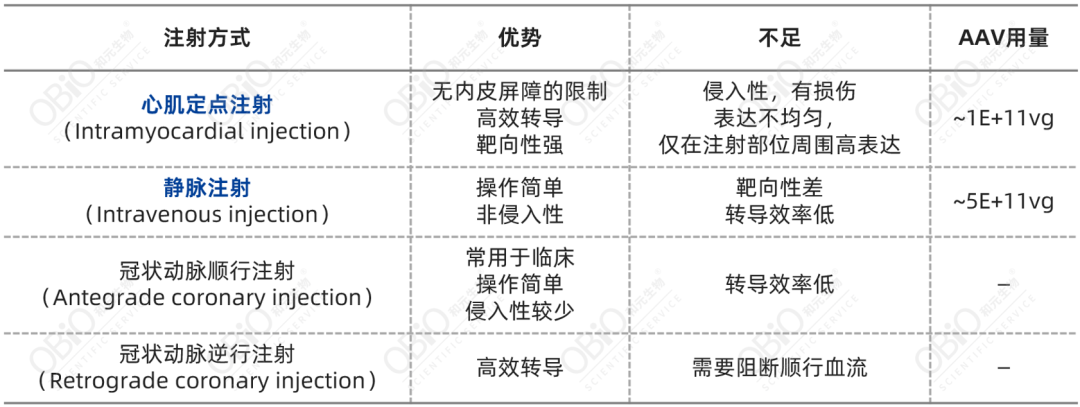
注:表中AAV用量为成年小鼠注射剂量。
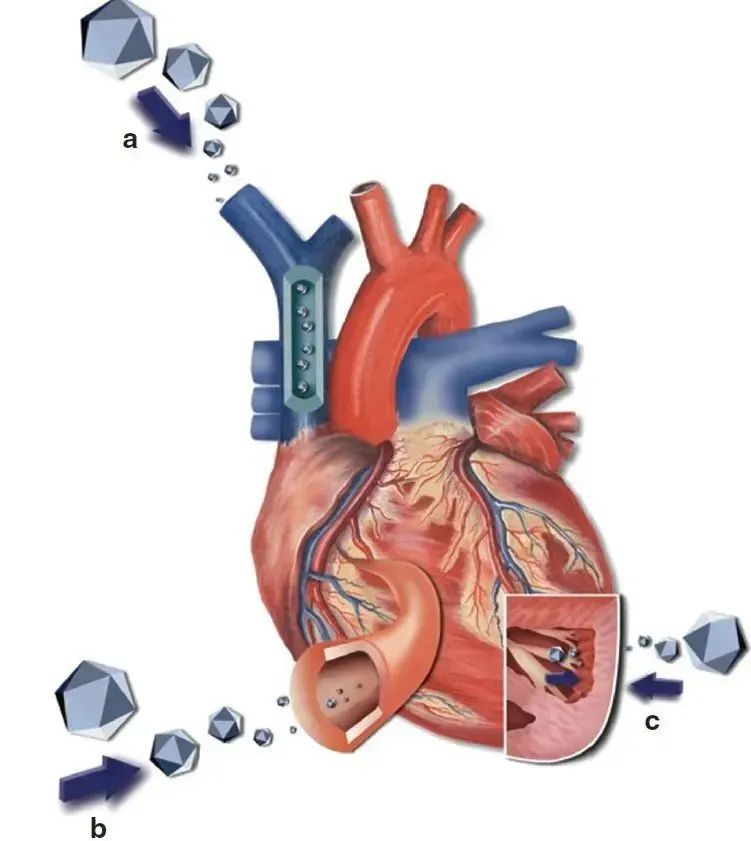
基于rAAV载体的心脏基因递送方式(PMID: 21792180)。(a) 静脉注射(Systemic venous delivery);(b)冠状动脉注射(coronary delivery);(c)心肌定点注射(Intramyocardial delivery)
04 应用案例
2025年,宁波市医疗中心李惠利医院的研究团队在NPJ Biofilms and Microbiomes发表了一项关于肠道微生物群影响心脏纤维化的机制研究。研究人员借助和元构建的AAV9载体,配合和元优化的启动子,特异性干扰心肌细胞中AhR的表达,证明细菌代谢物IPA的心脏保护作用具有AhR依赖性。
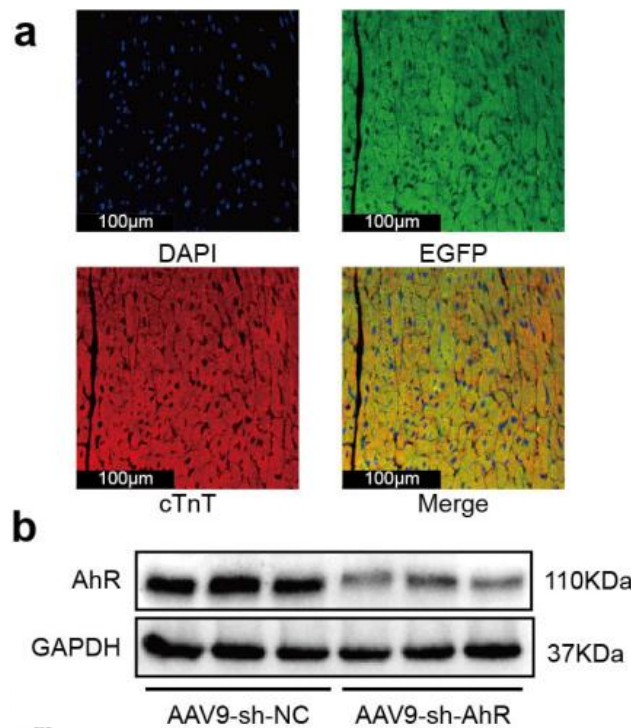
图7:AAV9 在小鼠心脏中的感染效果(PMID: 40410194)

2024年,上海市第六人民医院的研究团队在Cell Communication and Signaling发表关于心脏适应不良重塑发病机制的研究成果。研究过程中使用了和元构建的AAV9血清型配合Postn启动子,抑制心脏肌成纤维细胞中Slc7a5的表达。
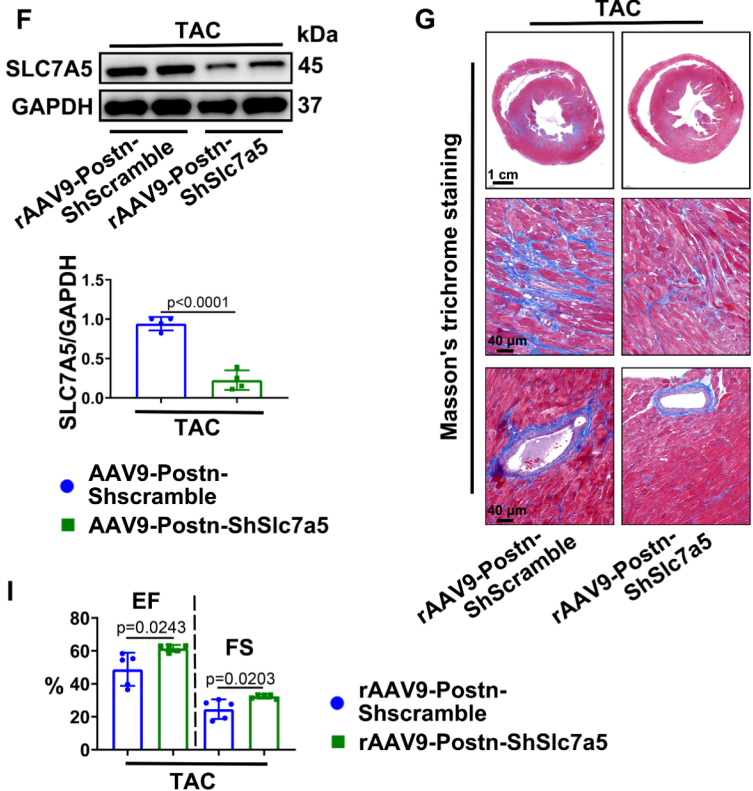
图8:AAV9-Postn-shSlc7a5抑制小鼠心脏成纤维细胞中Slc7a5的表达(PMID: 39304904)
2023年,江南大学无锡医学院的研究团队在British Journal of Pharmacology发表关于调节冠状动脉血管张力的研究成果。研究人员利用和元构建的携带hFLT1启动子的AAV载体,在小鼠血管内皮细胞中特异性过表达KCa3.1和KCa3.1-AR3,从而进行后续研究。
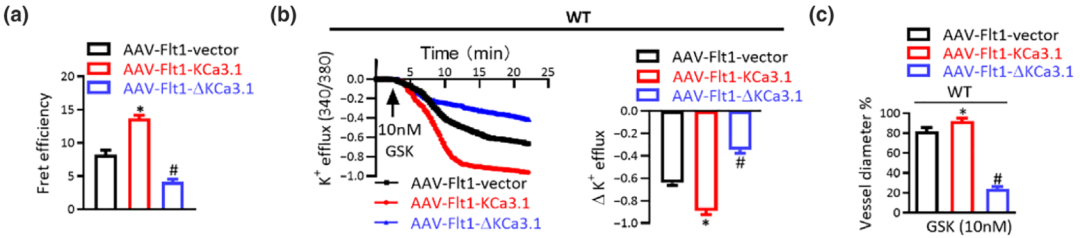
图9:AAV配合hFLT1启动子实现小鼠血管内皮细胞中特异性过表达(PMID: 37005734)
参考文献
[1] Circ Res. 2020 Apr 10;126(8):1024-1039. doi: 10.1161/CIRCRESAHA.119.315956.
[2] Gene Ther. 2011 Jan;18(1):43-52. doi: 10.1038/gt.2010.105.
[3] Mol Ther. 2011 Sep;19(9):1582-90. doi: 10.1038/mt.2011.124.
[4] Hum Gene Ther. 2019 Oct;30(10):1284-1296. doi: 10.1089/hum.2019.027.
[5] Clin Sci (Lond). 2021 Jun 11;135(11):1369-1387. doi: 10.1042/CS20210052.
[6] NPJ Biofilms Microbiomes. 2025 May 23;11(1):86. doi: 10.1038/s41522-025-00712-y.
[7] Cell Commun Signal. 2024 Sep 20;22(1):444. doi: 10.1186/s12964-024-01826-0.
[8] Br J Pharmacol. 2023 Sep;180(17):2266-2279. doi: 10.1111/bph.16082.







