和元生物技术(上海)股份有限公司品牌商
14 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
公司新闻/正文
Nature genetics| ESCC GPR116+周细胞通过PRRX1-EGFL6-整合素β1-NF-kB轴调控肿瘤转移
421 人阅读发布时间:2025-10-15 14:30
肿瘤转移是癌症死亡的主因,食管鳞状细胞癌(ESCC)具有隐匿性强、初诊时超 50% 患者已发生转移的特点,5 年总生存率仅约 20%。尽管周细胞(血管壁细胞)是 TME 的重要组成部分,但此前对其异质性、在肿瘤转移与免疫逃逸中的功能及机制知之甚少。
2025年10月10日,广州医科大学研究团队在Nature genetics发表题为Single-cell multi-omic and spatial profiling of esophageal squamous cell carcinoma reveals the immunosuppressive role of GPR116+ pericytes in cancer metastasis的研究论文。
利用单细胞多组学(scRNA-seq\snRNA-seq\snATAC-seq,16个样本)和空间转录组学(Stereo-seq,5个样本)技术,揭示了食管鳞状细胞癌(ESCC)的细胞和空间结构,并表征了一个促进肿瘤转移和免疫疗法抗性的免疫抑制性GPR116+周细胞亚群。GPR116+周细胞的富集在转录水平上受到PRRX1的调控,且通过特异性Prrx1基因敲除小鼠得到了验证。机制上,GPR116+周细胞分泌EGFL6,通过与癌细胞上的整合素β1结合,激活NF-κB通路,促进转移。血清EGFL6作为一种非侵入性生物标志物,可用于多种肿瘤的诊断和预后。阻断整合素β1可抑制转移并改善食管鳞状细胞癌小鼠模型中的免疫疗法反应。
总的来说,提供了一个食管鳞状细胞癌中促进转移的肿瘤微环境空间分辨图谱,首次发现GPR116+周细胞在癌症转移中的关键作用,为转移性 ESCC 的诊断、预后与治疗提供新靶点和生物标志物。
·研究方法·
整合单细胞多组学与空间转录组技术来多维度解析TME,覆盖 12 例 ESCC 患者(6 例转移、6 例非转移)临床样本,具体包括:
①单细胞层面
16 个样本的 scRNA-seq、snRNA-seq、snATAC-seq,解析细胞组成、基因表达与染色质可及性;
②空间层面
5 个样本的 Stereo-seq,定位细胞空间分布与互作;
③功能验证
构建周细胞特异性基因敲除小鼠模型、转移动物模型(肺转移、淋巴结转移)、3D 凝胶侵袭实验、共培养实验等;
④临床验证
利用 364 例 ESCC 组织芯片、135 例 ESCC 患者血清及多癌种(肺癌、胃癌)血清样本,验证生物标志物的临床价值。
·核心研究结果·
1. GPR116+周细胞:ESCC 转移的关键亚群,具有独立预后价值
为了系统地表征ESCC转移,收集了包括转移性(T_M, n = 6)和非转移性(T_NM, n = 6) ESCC患者的原发肿瘤,以及配对的正常组织。采用单细多组学方法,包括scRNA-seq、snRNA-seq、snATAC-seq和Stereo-seq,在单细胞和空间水平上解剖ESCC中转移性TME的细胞组成和功能变化(图1a)。识别出14种主要类型(图1b)。与正常组织相比,成纤维细胞、周细胞、内皮细胞和中性粒细胞在肿瘤组织中比例显著改变,表明它们在肿瘤生长中起着至关重要的作用。细胞相互作用分析表明,基质细胞主要作为信号发送者,其中周细胞在转移癌患者中表现出最强的外向相互作用信号增加(图1c)。在转移性癌症患者中观察到周细胞与上皮细胞之间相互作用的最大增加(图1d),表明上皮细胞是转移过程中周细胞释放的信号的关键受体。
利用Stereo-seq对5例ESCC患者(nT_NM = 2, nT_M = 3)研究了ESCC中原转移性TME的空间组织结构。在空间接近性方面,T细胞-肿瘤细胞距离与转移状态无关,而B细胞与转移癌患者的肿瘤细胞距离略远。在转移性癌症患者中,基质细胞和骨髓细胞与肿瘤细胞的距离更近,其中周细胞在空间接近性上的增加最为显著(图1e)。在转移性癌症患者中,周细胞表现出显性的外向相互作用,其空间接近性和与肿瘤细胞的相互作用明显更近,这表明周细胞是研究转移性ESCC机制的关键候选者。
为了进一步探索ESCC中周细胞的异质性,对周细胞进行亚簇分析,标记了STEAP4+、SORBS2+和GPR116 +这3个亚群(图1f、g)。接下来,从ESCC肿瘤中分离的周细胞经验证后分为GPR116+和GPR116-周细胞(图1k,l,m)。ESCC样本的流式细胞术分析和组织微阵列显示,转移性癌患者的GPR116周细胞显著富集(图1n,o)。较高的GPR116+周细胞比例与较短的生存期相关(图1p)。多因素Cox回归分析进一步证实了GPR116+周细胞是ESCC的独立预后因素(图1 q)。这些数据令人信服地强调了GPR116周细胞在ESCC转移中的临床意义。
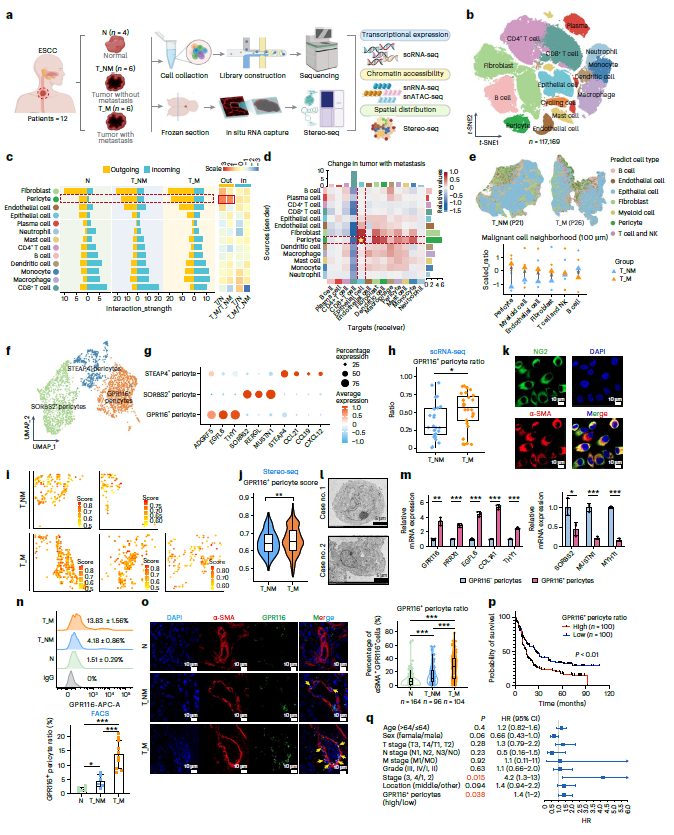
图1 GPR116+周细胞在ESCC转移中的作用
2. PRRX1 驱动 GPR116⁺周细胞分化
为了阐明GPR116+周细胞分化,SCENIC分析以筛选潜在调控因子,其中PRRX1、SOX4和HIF1A在转移性癌症患者GPR116+周细胞中显著上调(图2a,b)。PRRX1与GPR116+周细胞标记物表现出最强的相关性(图2c),TCGA队列也证实了PRRX1和GPR116周细胞之间最强的正相关。scRNA-seq结果显示,GPR116+周细胞中PRRX1活性和表达均显著增加(图2d,e)。临床组织验证也显示,转移癌患者和GPR116周细胞中PRRX1表达显著上调(图2f)。
进一步分析了PRRX1是否驱动GPR116+周细胞分化。过表达 PRRX1 可显著提高 GPR116⁺周细胞比例,敲低则相反(图2g)。snATAC-seq数据中,GPR116、EGFL6和THY1在GPR116+周细胞的染色质可及性升高(图2h)。ChIP和荧光素酶报告基因实验进一步证实了PRRX1与GPR116和EGFL6启动子的结合(图2i)。与其转录激活相对应,PRRX1在GPR116+周细胞中表现出更强的转录因子基序结合活性富集(图2j)。周细胞特异性 Prrx1 敲除(Cspg4-CreERT 介导)小鼠中,GPR116⁺周细胞完全消失,且 ESCC 淋巴结转移率从 100% 降至 20%,证明 PRRX1 是 GPR116⁺周细胞分化的必需因子(图2K-l)。这些数据表明,PRRX1作为GPR116+周细胞特异性转录因子,调控其细胞分化。
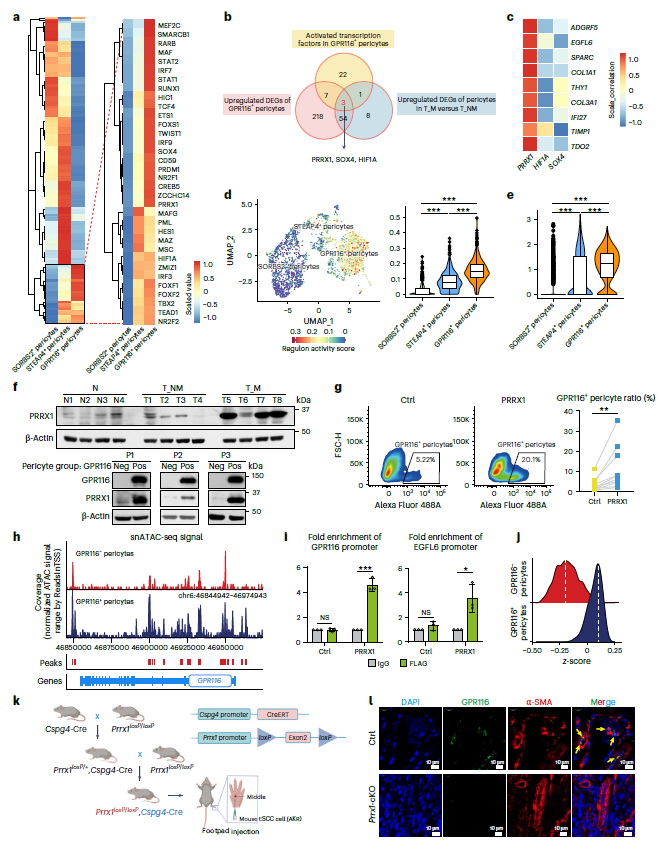
图2 PRRX1驱动GPR116+周细胞的分化
3. GPR116+周细胞参与ESCC转移
CellChat分析显示,GPR116+周细胞在所有细胞类型中表现出最高强度的外向相互作用(图3a),与肿瘤细胞的相互作用增加(图3b)。根据EMT特征将肿瘤细胞分为Non_EMT、Low_EMT、High_EMT,值得注意的是,在转移性癌症患者中,GPR116+周细胞与High_EMT肿瘤细胞之间的相互作用最强(图3c)。随着接近侵袭性肿瘤边界,GPR116+周细胞逐渐增加(图3d,e)。这些结果表明,GPR116+周细胞与High_EMT肿瘤细胞近距离接触,可能在驱动肿瘤侵袭和转移中起关键作用。GPR116+周细胞比GPR116-周细胞更能增强ESCC细胞的侵袭和EMT过程(图3f-m)。这些发现共同强调了prrx1驱动的GPR116+周细胞在促进ESCC转移中的重要作用。
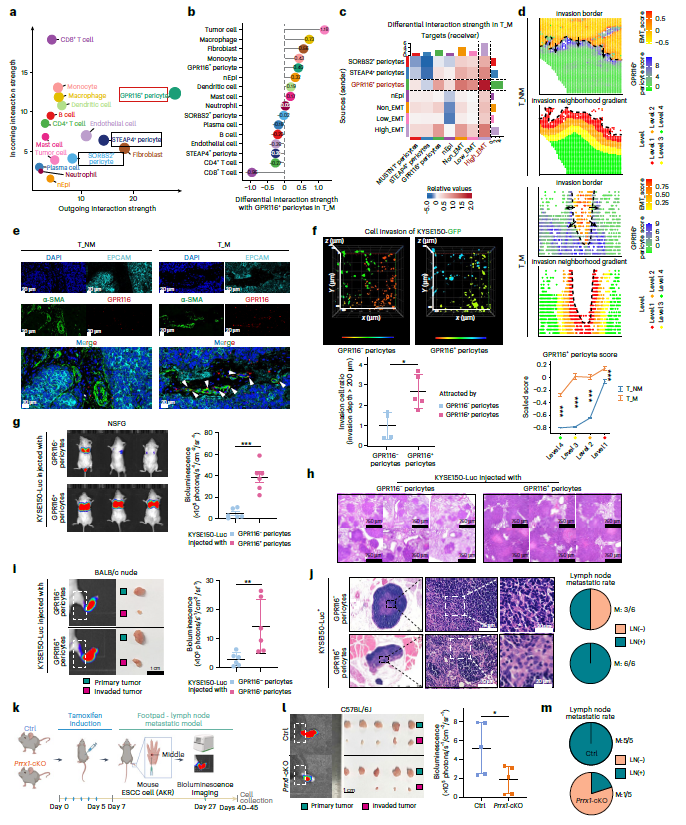
图3 GPR116+周细胞参与ESCC转移
4. GPR116+周细胞通过 EGFL6–整合素 β1–NF-κB 轴促进 ESCC 转移
通过比较GPR116+周细胞与GPR116-周细胞的表达谱,发现EGFL6是上调倍数最多的基因(图4a,b)。EGFL6在GPR116+周细胞中特异性表达(图4c)。周细胞特异性Prrx1 KO小鼠肿瘤组织和血清中EGFL6水平的降低,表明GPR116+周细胞是EGFL6的主要来源(图4d)。此外,EGFL6在转移患者的GPR116+周细胞中的表达明显高于未转移患者(图4e),在TCGA-ESCC队列中也观察到(图4f)。EGFL6以剂量依赖性方式显著增强ESCC细胞侵袭(图4h,i),并伴有EMT特征增加(图4j),突出了EGFL6在促进侵袭和转移中的作用。
探索了EGFL6作为ESCC诊断和预后生物标志物的潜力。对303例ESCC样本的组织微阵列分析显示,转移性癌患者中EGFL6的表达明显更高(图4k)。更关键的是,EGFL6的高表达预示ESCC患者预后较差(图41)。在TCGA数据集和组织队列中观察到EGFL6和GPR116周细胞表达之间存在强正相关(图4,m)。鉴于EGFL6是一种分泌蛋白,收集了135例ESCC患者和60例健康对照者的血清样本并进行ELISA检测,结果显示ESCC患者中EGFL6显著升高,且在转移性癌症患者中梯度增强(图4n)。重要的是,血清EGFL6不仅在区分ESCC患者和健康人方面显示出很高的预测价值(AUC = 0.983),而且对转移也具有诊断潜力(AUC = 0.912;图4p)。血清EGFL6进一步显示了对肺癌(AUC = 0.902;图4q)和胃癌(AUC = 0.808;图4r)转移的预测潜力。这些结果共同表明,血清EGFL6是一种有效的无创生物标志物,可用于人类癌症的早期诊断和预后。
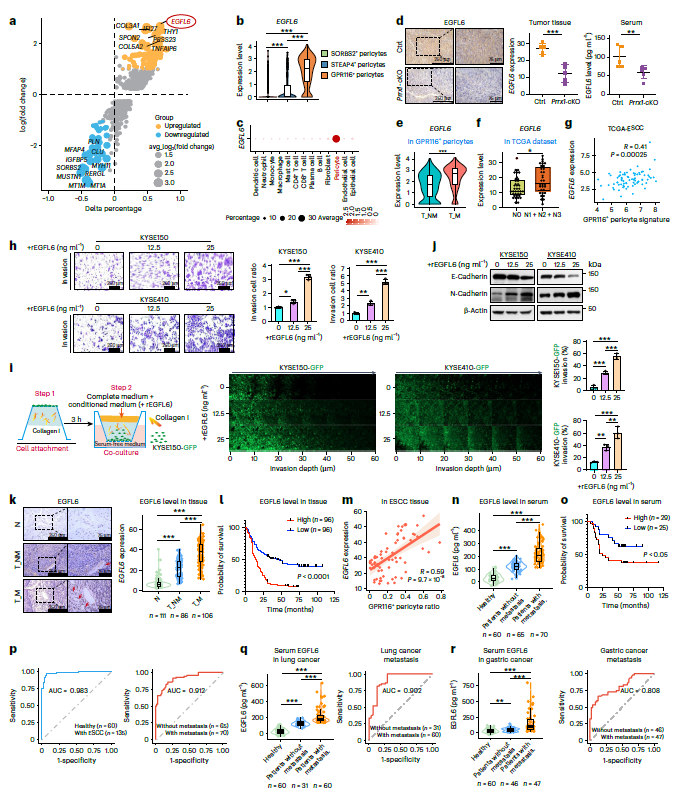
图4 EGFL6的促转移作用及其临床意义
为了研究周细胞-肿瘤细胞的串扰,探索了配体-受体的相互作用,发现GPR116+周细胞通过EGFL6-整合素β1的相互作用与High_EMT肿瘤细胞互作(图5a)。在EGFL6受体中,整合素β1与EMT能力和转移的相关性最强,因此作为研究重点(图5b)。整合素β1主要在High_EMT肿瘤细胞中表达,在转移性癌症患者中显著过表达(图5d)。在机制上,NF-κB信号是高EMT肿瘤细胞中除了EMT途径外最富集的途径(图5e),并且在转移性癌症患者中表现出更高的活性(图5f)。EGFL6激活ESCC细胞中NF-κB通路呈剂量依赖性,p-p65水平升高(图5g)。重要的是,整合素β1 (ATN-161)或NF-κB (BAY 11-7082)抑制剂显著消除了EGFL6对细胞侵袭和EMT的增强作用(图5h,i)。这些结果共同提示GPR116周细胞通过EGFL6-整合素β1-NF-κB轴促进转移。鉴于这些发现,进一步评估了靶向整合素β1的治疗潜力。Volociximab治疗显著降低了ESCC动物模型中的淋巴结转移(图5j)。volociximab治疗小鼠在腘窝近端和髂淋巴结中的肿瘤浸润最小,无远端肾门淋巴结转移(图5k)。综上所述,这些数据表明EGFL6-整合素β1-NF-κB轴在肿瘤转移中起关键作用。
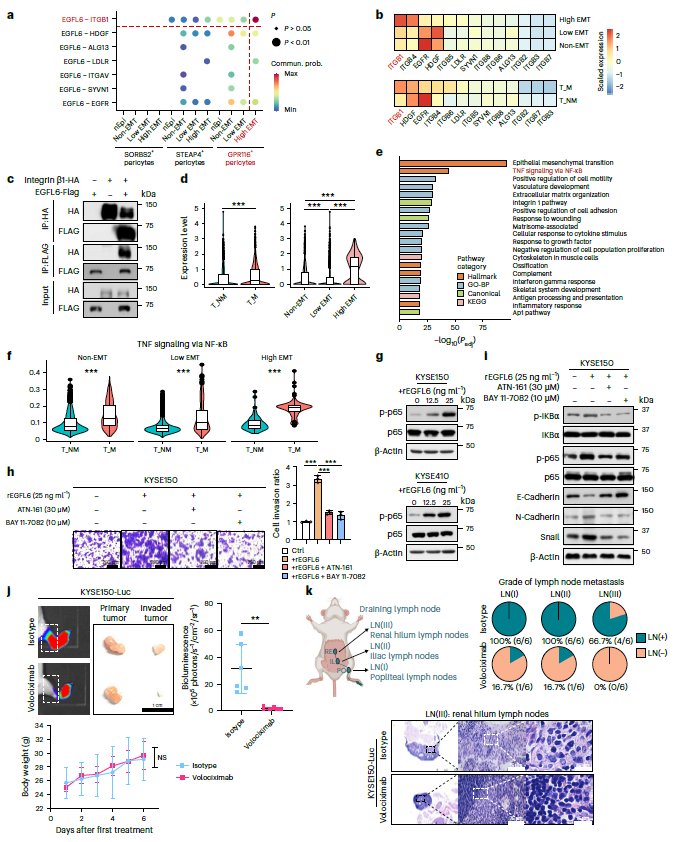
图5 GPR116+周细胞通过EGFL6-整合素β1-NF-κB轴诱导转移
5. GPR116+周细胞的免疫抑制作用:促进免疫逃逸与免疫治疗耐药
PD-1+CD8+T细胞和Treg细胞在GPR116+周细胞周围富集,且具有强相关性;在转移性ESCC患者中观察到更高的富集(图6a)。与GPR116+周细胞共培养后,PD-1+CD8+T和FOXP3+CD4+T细胞增加(图6b,c)。重要的是,GPR116+周细胞显著上调了癌细胞中PD-L1的表达,而这种作用可以被整合素β1抑制剂逆转(图6f,g)。总的来说,通过(1)促进Treg细胞扩增,发挥GPR116+周细胞的免疫抑制作用;(2)诱导CD8+T细胞衰竭,降低其细胞毒性;(3)上调肿瘤细胞中的PD-L1以逃避免疫监视;最终实现GPR116+周细胞调控免疫细胞的功能。
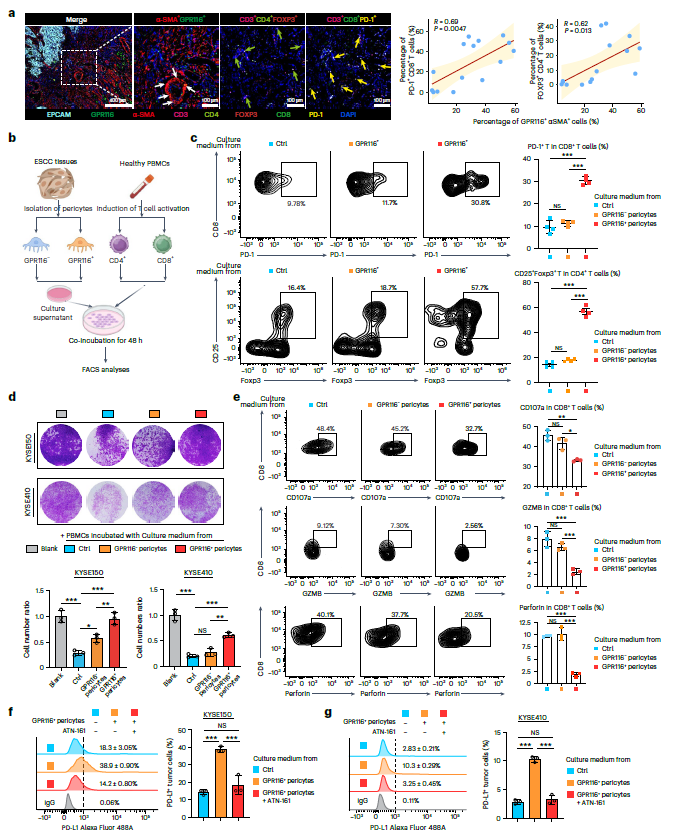
图6 GPR116+周细胞的免疫抑制特性
6. 联合治疗策略:整合素 β1 抑制剂 +αPD-1,显著增强抗转移与抗肿瘤效果
GPR116+周细胞的免疫抑制能力促使作者研究整合素β1抑制剂和免疫检查点阻断(ICB)联合治疗的协同作用。ATN-161是一种安全的整合素α5β1拮抗剂,已在一项I/II期试验中进行联合治疗评估。在 C57BL/6J 皮下肿瘤小鼠模型中,ATN-161与 αPD-1 联合治疗比单药更显著抑制肿瘤生长,且无明显毒副作用(图7a-e)。为了模拟晚期ESCC转移,建立了自发转移小鼠模型(图7f)。4-NQO 诱导的 ESCC 自发转移小鼠中,联合治疗可同时抑制原发肿瘤进展和肺转移(图7g-k)。这些临床前结果表明,ATN-161和αPD-1联合治疗晚期ESCC具有潜在治疗潜力。
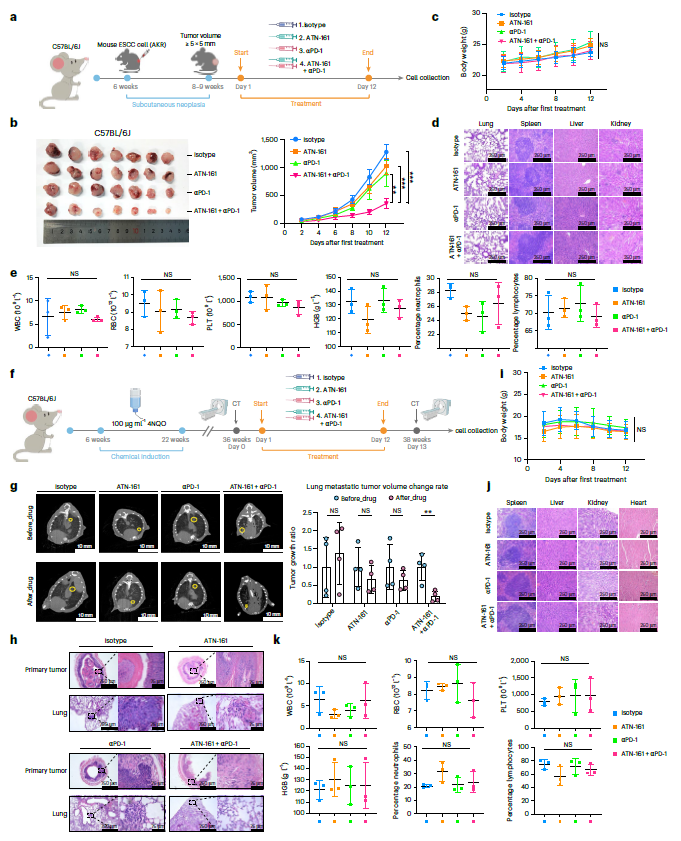
图7 整合素β1抑制剂可增强αPD-1的抗肿瘤作用
·总结·
本研究通过多维度技术构建了 ESCC 转移相关 TME 的单细胞与空间图谱,首次明确GPR116+周细胞是 ESCC 转移与免疫抑制的关键驱动因素,揭示其调控机制与临床价值。阐明 PRRX1-EGFL6-整合素 β1-NF-κB 轴的调控网络,丰富了 TME 细胞互作与转移机制的认知。为转移 ESCC 的精准诊断(血清 EGFL6)、预后评估(GPR116+周细胞比例)和联合治疗(整合素 β1 抑制剂 + 免疫治疗)提供了新的理论依据与转化方向,有望改善转移性癌症患者的生存预后。
和元多组学服务
和元生物提供多组学服务(如转录组、Astral蛋白组、代谢组、微生物组、Cut&Tag、MeRIP (m6A)-seq、WGBS、RRBS等)和单细胞及空间转录组服务(如10x单细胞转录组、10x单细胞转录组及TCR/BCR、墨卓单细胞转录组、DNBelab C-TaiM4单细胞转录组、CytAssist空间转录组、HD空间转录组、Stereo-seq 空间转录组等),致力于为广大生命科学家、医学工作者提供基于多组学的科研及临床应用解决方案。累计协助客户在Advanced Science、Journal of Nanobiotechnology、Advanced Functional Materials、ACS Nano、Nature Aging、Neuron等期刊发表SCI论文,并推出了广受好评的生信分析云平台,助您高效实现个性化数据挖掘!
业务咨询:15800353038


和元生物技术(上海)股份有限公司(股票代码:688238)作为一家在科创板上市的高新技术企业,自2013年成立以来,始终深耕细胞和基因治疗核心领域。公司专注于为细胞和基因治疗的基础研究提供基因治疗载体研制、基因功能研究、药物靶点及药效研究等CRO服务;为细胞与基因治疗药物的研发提供工艺开发及测试、IND-CMC药学研究、临床样品及商业化产品的GMP生产等CDMO服务;为再生医学及抗衰领域提供细胞制备、重组蛋白/外泌体等细胞衍生物生产、细胞存储等技术服务。致力于推动细胞和基因治疗及相关健康产业的技术开发及转化应用,造福生命健康。
公司秉承“整合你我资源,服务生命科学”的理念,坚守“客户第一、高效执行、追求卓越、创新突破、诚信务实”的价值观,已成长为一家集基因功能基础研究服务、临床级细胞与基因治疗药物商业化生产服务、再生医学服务三大发展方向于一体的高新技术企业。







