和元生物技术(上海)股份有限公司品牌商
13 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
公司新闻/正文
肺脏专场 | 靶向体内各种细胞的AAV「好物分享」
493 人阅读发布时间:2025-09-30 15:41
肺脏作为人体与外界进行气体交换的关键器官,其功能的正常发挥依赖于肺泡上皮细胞、肺血管内皮细胞、肺血管平滑肌细胞、肺巨噬细胞等多种细胞类型的协同作用。当不同肺细胞出现功能异常或受损时,不仅会影响气体交换效率,更可能诱发慢性阻塞性肺疾病、肺纤维化、肺癌等多种严重肺部疾病,给健康带来巨大威胁。
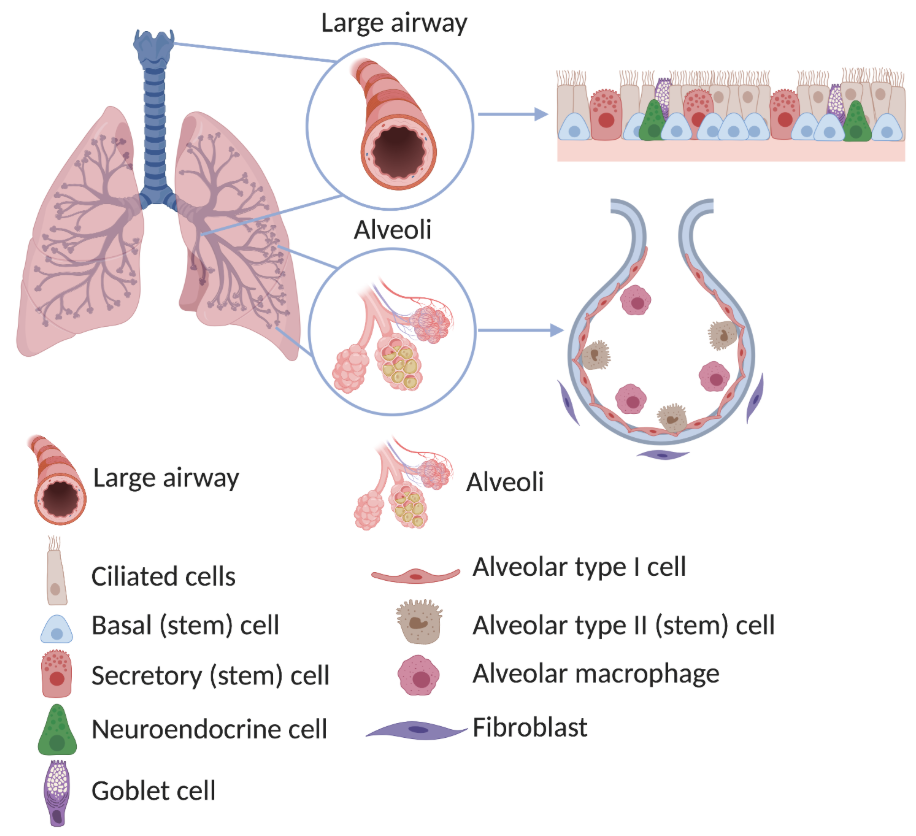
肺脏结构及主要细胞类型(From EuroStemCell)
随着肺部疾病研究向细胞特异性机制探索的深入,精准靶向特定肺细胞的研究工具成为关键需求。腺相关病毒(AAV)载体凭借免疫原性低、长期稳定表达外源基因、可通过不同血清型和启动子实现细胞靶向性等优势,成为靶向肺脏不同细胞类型研究的理想载体。
靶向肺泡Ⅱ型上皮细胞的AAV「好物」
推荐
AAV-LungM3血清型,
AAV6血清型/AAV6.2ff血清型+SP-C启动子
肺泡II型上皮细胞(也称肺泡II型细胞,alveolar type II cell,AT2)是肺泡中体积较小的立方形细胞,表面有微绒毛,内部富含线粒体,具有代谢活跃的特征。AT2是肺泡的保卫者,能够合成和分泌表面活性物质,修复损伤的肺泡。
和元生物授权的血清型——AAV-LungM3。该血清型在小鼠模型中以低剂量的病毒颗粒,通过气管内注射,高效转导肺脏,并且具有AT2亲嗜性。
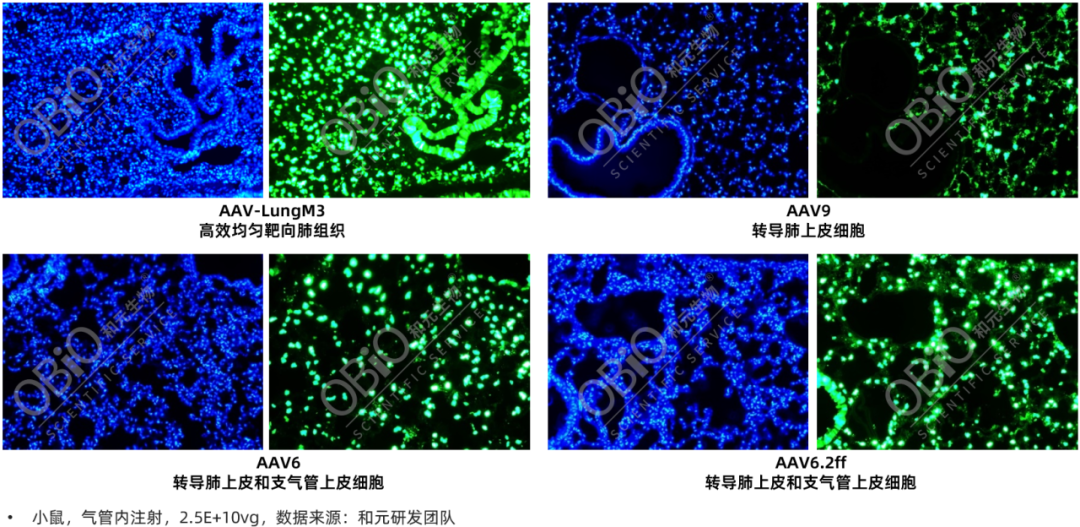
AAV不同血清型气管内注射感染肺脏效率比较
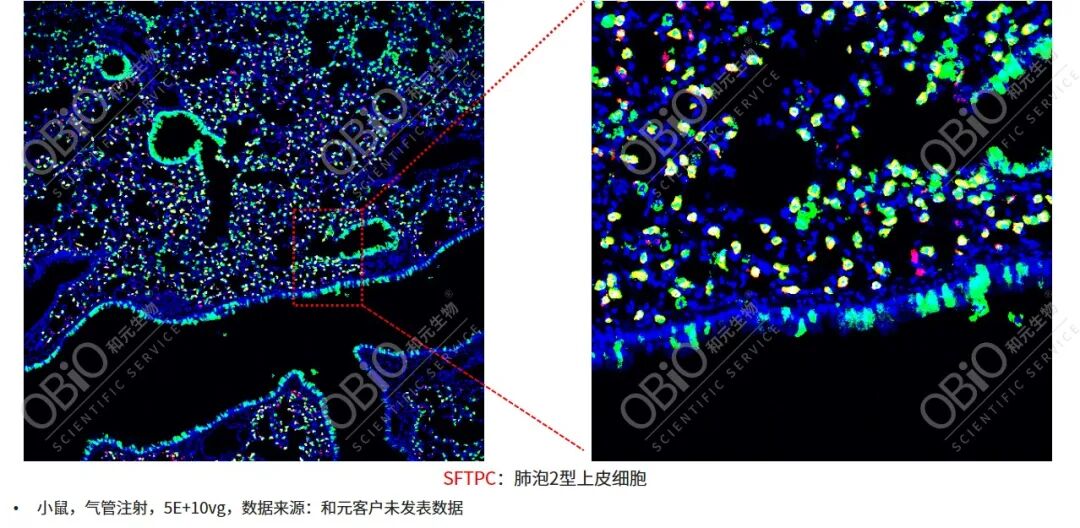
AAV-LungM3气管内注射靶向AT2
2025年,中国医学科学院北京协和医学院曹雪涛院士团队通过小鼠体内CRISPR筛选来鉴定炎症消退的关键代谢介质,发现了一种极长链脂肪酸延长酶ELOVL5,可以促进流感病毒感染后肺部炎症的消退。研究人员利用携带sgRNA或shRNA的AAV-LungM3特异性敲低小鼠AT2细胞中的Elovl5,验证了ELOVL5能促进流感病毒感染后的肺部炎症消退和组织修复。该病毒载体由和元提供。
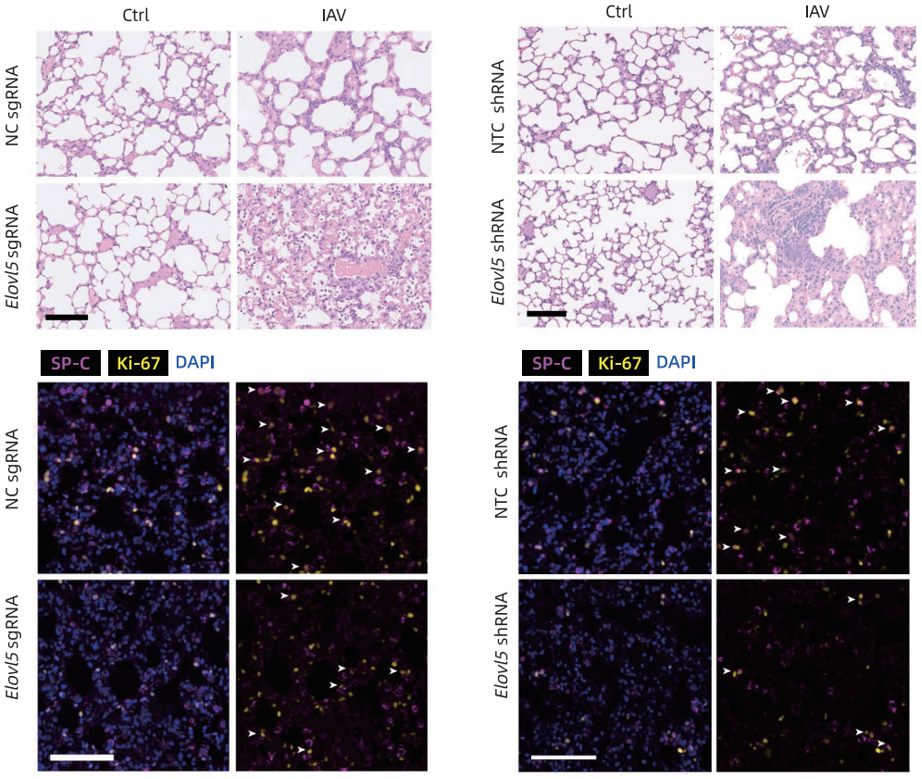
Elovl5敲除小鼠的肺部炎症加重(Shuo Liu et al., bioRxiv, 2025)

表面活性蛋白C (SP-C) 是一种存在于肺表面活性物质中的高疏水性蛋白,仅在AT2细胞中合成。SP-C能够增强磷脂在气液界面的吸附和扩散,从而有助于降低表面张力,其在维持正常肺功能的过程中起着非常重要的作用。SP-C启动子也被作为AT2细胞的特异性启动子。通常建议用AAV6或AAV6.2ff血清型配合SP-C启动子,通过气管注射,特异性靶向AT2细胞。
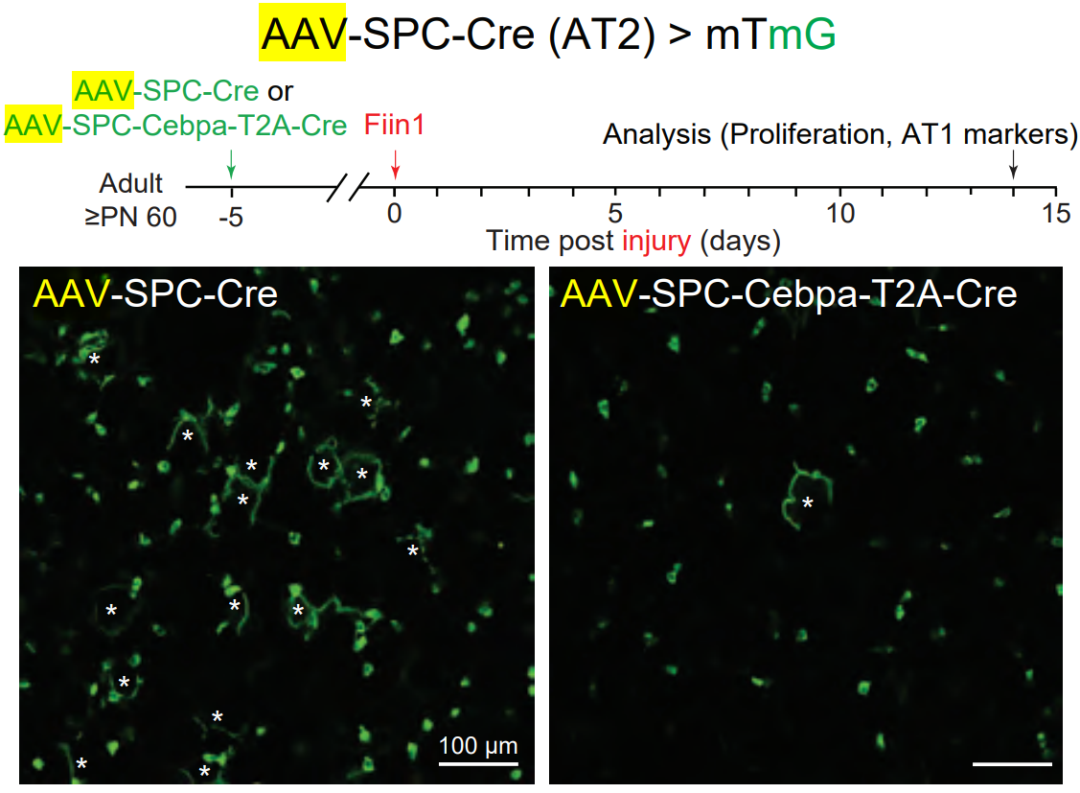
诱导成年Rosa26 mTmG小鼠的AT2细胞中表达GFP-Cre或Cebpa(Amitoj S Sawhney et al., bioRxiv, 2025)
靶向肺内皮细胞的AAV「好物」
推荐
AAV-LungX血清型
肺脏是一个高度血管化的器官,主要功能是促进氧气通过血流的转移,在这过程中,肺部内皮细胞(endothelial cells, ECs)至关重要。研究发现,ECs的功能异常往往参与多种肺部疾病的发生发展,如慢性阻塞性肺病、肺纤维化、肺动脉高压、肺炎、急性呼吸窘迫综合征、自身免疫性疾病等。
和元生物自主创建的AAVneO®全新AAV血清型发现平台,开发了一种具有自主知识产权的新型AAV递送载体——AAV-LungX。该血清型在小鼠模型中通过静脉注射,以较低剂量的病毒颗粒实现高效转导肺脏且精准靶向肺内皮细胞。此外,AAV-LungX基本不会在肝脏富集,避免了可能引起的肝毒性等副作用,为研究肺部疾病提供了一种更安全、更有效的递送载体。
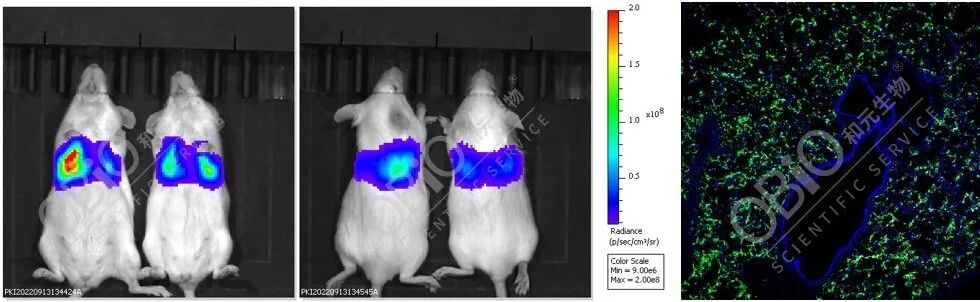
AAV-LungX尾静脉注射肺脏转导
(5E+11vg/只;左:小动物活体成像结果;右:荧光结果)
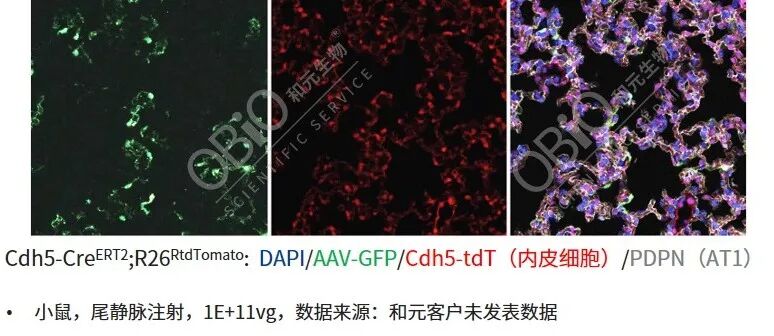
AAV-LungX尾静脉注射靶向肺内皮细胞
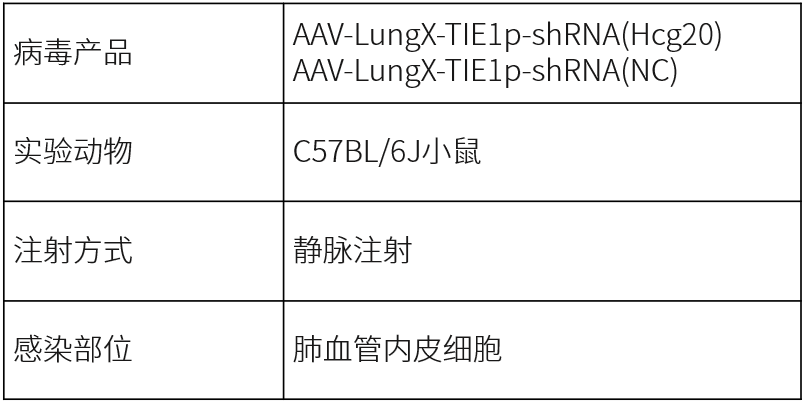
2025年,哈尔滨医科大学/厦门大学附属心血管病医院的研究团队在Circulation Research杂志(IF=16.5)发表研究成果,揭示了超级增强子相关的HCG20调控肺动脉内皮细胞功能障碍的新机制。研究人员利用AAV-LungX血清型配合Tie1启动子的病毒载体,在小鼠体内肺血管内皮细胞中抑制Hcg20的表达。该病毒载体由和元提供。
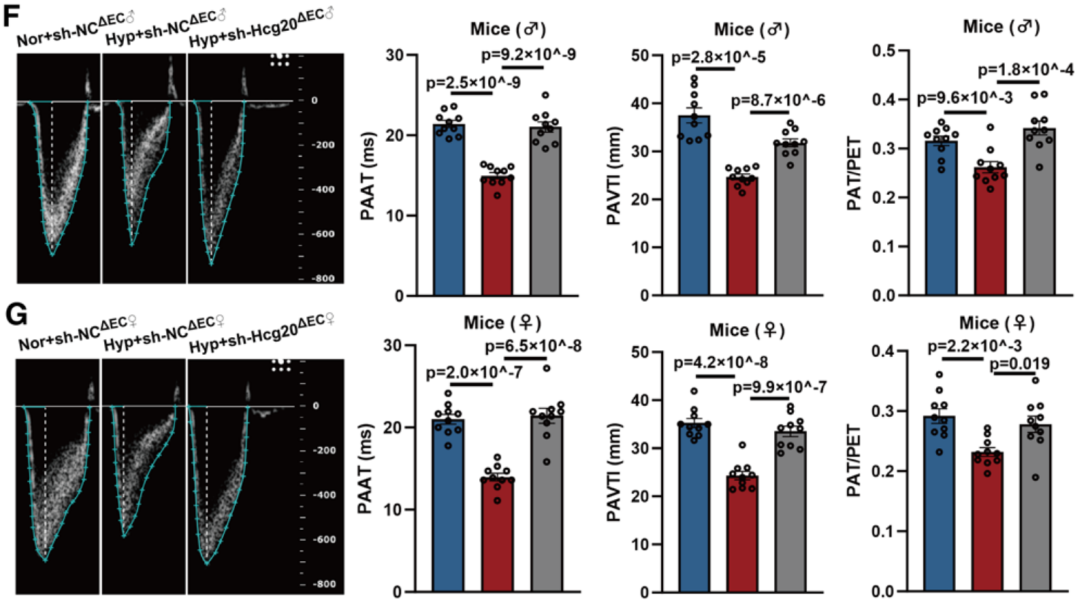
肺血管内皮Hcg20缺陷小鼠在低氧环境下的生理表型(Jian Mei, Circulation Research, 2025)
靶向肺血管平滑肌细胞的AAV「好物」
推荐
AAV2血清型/AAV9血清型+SM22α启动子
肺血管平滑肌(Pulmonary vascular smooth muscle)通过收缩和舒张来调节肺部的血流和压力,在生理和病理血管中起着核心作用。举例来说,肺动脉平滑肌细胞的增殖和凋亡会导致肺动脉高压等情况下的血管重塑和肺血管阻力升高。
SM22α蛋白在平滑肌细胞中特异性表达,是维持血管平滑肌细胞收缩表型所必需的一种重要细胞骨架相关蛋白。SM22α启动子可以配合相应的AAV血清型靶向肺血管平滑肌细胞。
2023年,西部战区总医院的研究团队在Clinical And Experimental Hypertension发表了有关肺动脉高压和肺动脉重塑的研究成果。研究人员利用和元构建的AAV2-SM22α-STAT3C,通过尾静脉注射引入小鼠肺动脉平滑肌,以过表达STAT3C。
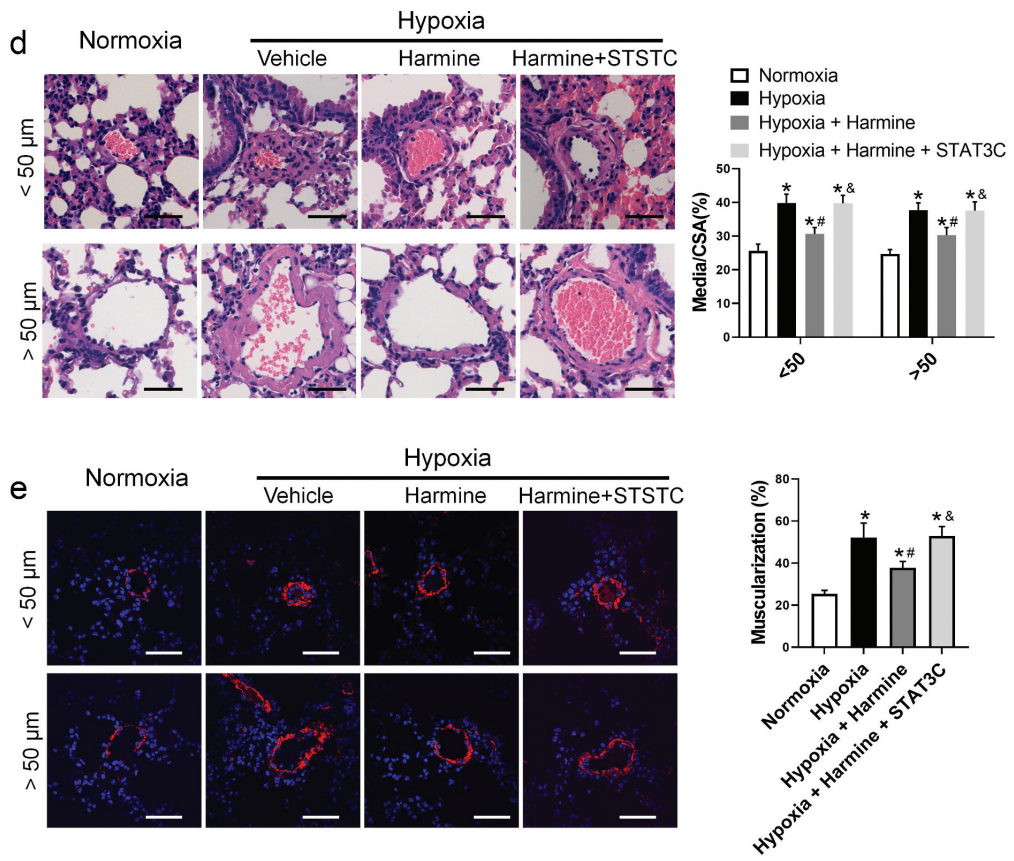
Harmine处理小鼠的肺血管壁厚度和肌肉化的减少因STAT3C功能获得而减轻(Cong Lan, et al., Clin Exp Hypertens., 2024)

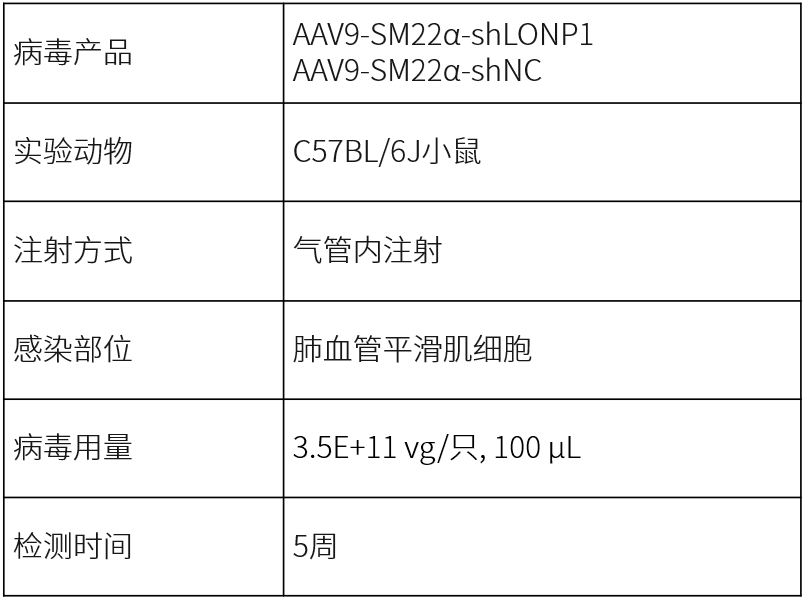
2025年,东南大学附属中大医院的研究团队在Clinical Science发表了同样与肺动脉高压相关的文章。研究人员利用和元构建的AAV9血清型配合SM22α启动子,抑制肺动脉平滑肌中LONP1基因的表达。
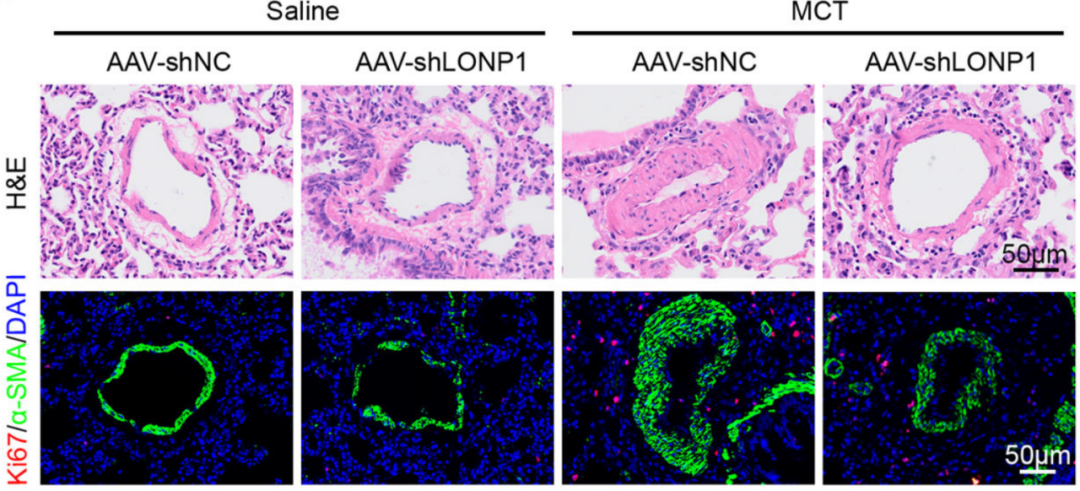
LONP1敲低显著减轻了Monocrotaline引起的肺动脉壁增厚(Mingkang Li, et al., Clinical Science, 2025)
在SM22α启动子前加上增强子来提高其效力,由此开发了EnSM22α启动子。此外,Alpha 8整合素(ITGA8)是一种跨膜蛋白,有研究表明itga8 mRNA 在血管平滑肌细胞中含量丰富,而在内脏平滑肌细胞中表达较少,因此itga8启动子可以特异性靶向血管平滑肌细胞。
靶向肺巨噬细胞的AAV「好物」
推荐
AAV6血清型/AAV6.2ff血清型+CD68启动子
肺巨噬细胞(lung macrophages)在清除病原体、免疫调节、维持体内平衡等环节中发挥着重要作用。肺泡巨噬细胞(alveolar macrophages, AM)和间质巨噬细胞(interstitial macrophages, IM)是肺中主要的巨噬细胞群,前者是肺泡和气道的第一线保卫者,后者则充当血管和肺间质的守门人,它们在稳态和疾病状态下均具有独特的特性。近年来,肺巨噬细胞及其在肺部疾病中的作用备受关注。
CD68和F4/80是常用的巨噬细胞特异性启动子。靶向小鼠体内肺巨噬细胞通常可以利用AAV6或AAV6.2ff血清型配合CD68或者F4/80启动子来实现。
近期,江南大学的研究团队在Advanced Science(IF=14.1)刊登了新研究成果,研究发现辅酶类蛋白可减少肺泡巨噬细胞中前列腺素D2的产生并缓解过敏性气道炎症。研究人员利用和元提供的AAV6血清型配合CD68启动子精准靶向Cotl1−/−小鼠体内肺巨噬细胞,调控肺巨噬细胞中CLP表达升高,减轻屋尘螨(HDM)诱导的炎症。
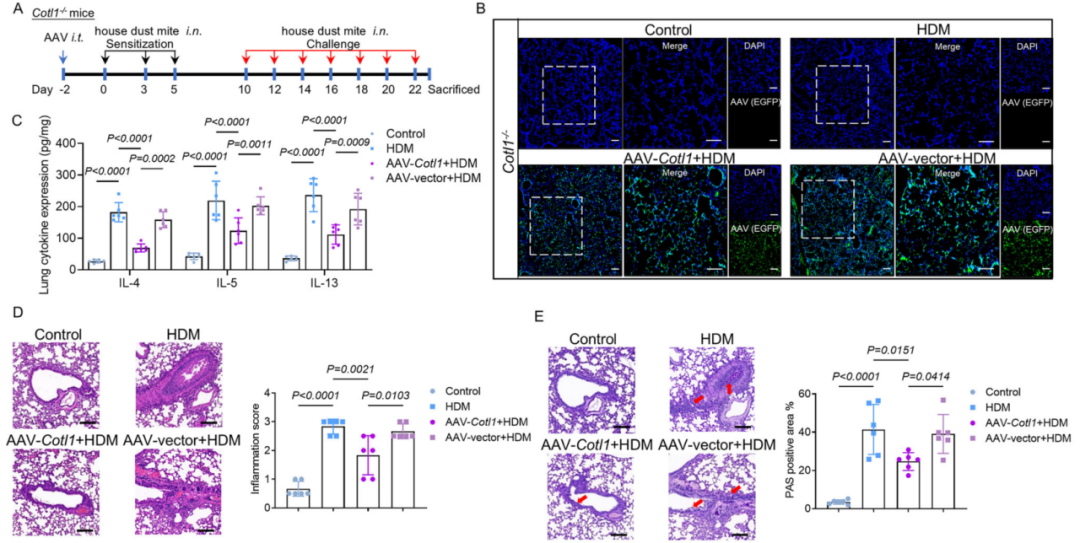
在Cotl1−/−小鼠肺巨噬细胞中补充CLP可逆转HDM诱导的气道炎症(Li-Long Pan, et al., Advanced Science, 2025)
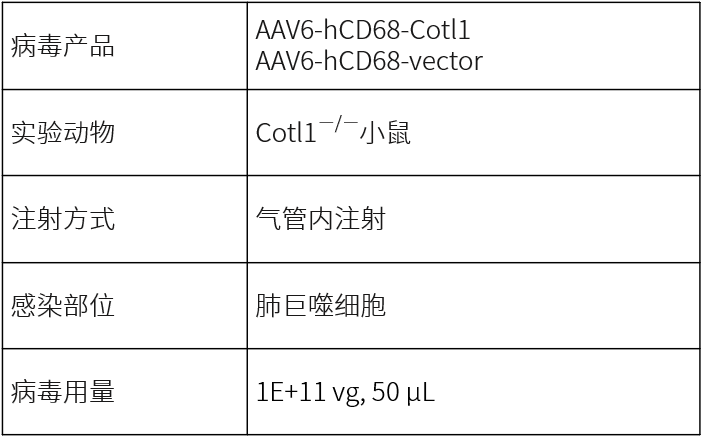
和元生物持续助力肺脏研究,并且不断拓展精准高效靶向肺脏的AAV产品。下表是对肺脏基因递送产品与经验的总结:

和元生物能够提供文中提到的所有AAV产品,并且在持续研发新产品中,欢迎咨询!
业务咨询:15800353038









