和元生物技术(上海)股份有限公司品牌商
14 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
公司新闻/正文
重磅STTT | “双靶点”铁死亡“核弹”!天然产物ACE如何精准引爆癌细胞?
328 人阅读发布时间:2025-09-12 16:22
在肿瘤治疗进入“精准+多靶点”时代的背景下,传统化疗药物因耐药、毒副作用大等问题逐渐显露出局限性。近年来,铁死亡(ferroptosis)作为一种新型程序性细胞死亡方式,因其对耐药肿瘤细胞的高效清除能力,成为肿瘤治疗研究的前沿热点。2025年国自然基金指南中,铁死亡机制与肿瘤治疗、天然产物多靶点作用机制、肿瘤类器官模型评价等方向被列为重点支持领域。近日,来自上海中医药大学与多家科研机构联合在《Signal Transduction and Targeted Therapy》发表了一项突破性研究,首次揭示天然小分子化合物 Acevaltrate(ACE)可通过双重靶向铁代谢调控蛋白PCBP1/2与铁死亡关键抑制因子GPX4,强效诱导结直肠癌细胞发生铁死亡。在细胞、类器官及动物模型中,ACE均表现出优于临床一线药物的抗肿瘤活性,且毒副作用低,展现出良好的临床转化前景。本文将围绕该研究展开深入解读。

第一步
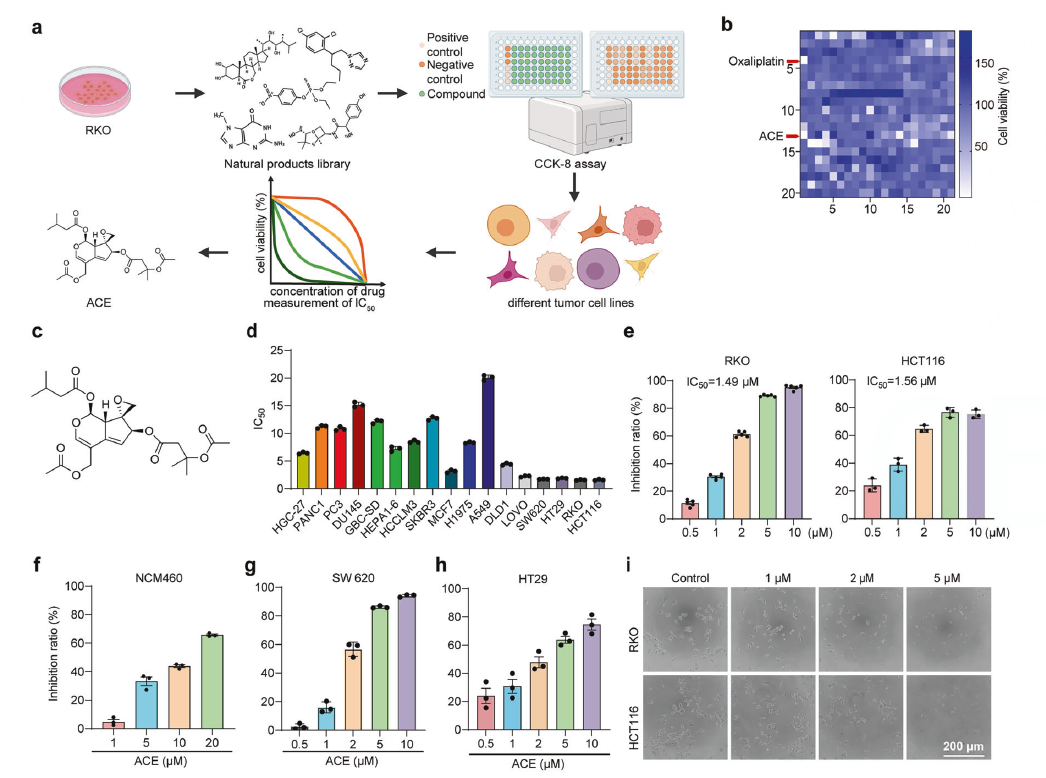
发现现象——筛选并鉴定出高效抗结直肠癌的天然产物ACE
思路:
从一个大型天然产物库中,寻找对结直肠癌细胞有强大杀伤作用的“候选药物”。
方法:
高通量筛选
使用CCK-8法,在RKO结直肠癌细胞上筛选420种天然化合物的抗肿瘤活性。
活性验证
对筛选出的13个候选化合物,在多种肿瘤细胞系中测定其半抑制浓度(IC50),发现ACE具有广谱且高效的抗癌活性,尤其对结直肠癌细胞系(IC50在1.4-1.9 μM),且对正常肠上皮细胞毒性较低。
表型确认
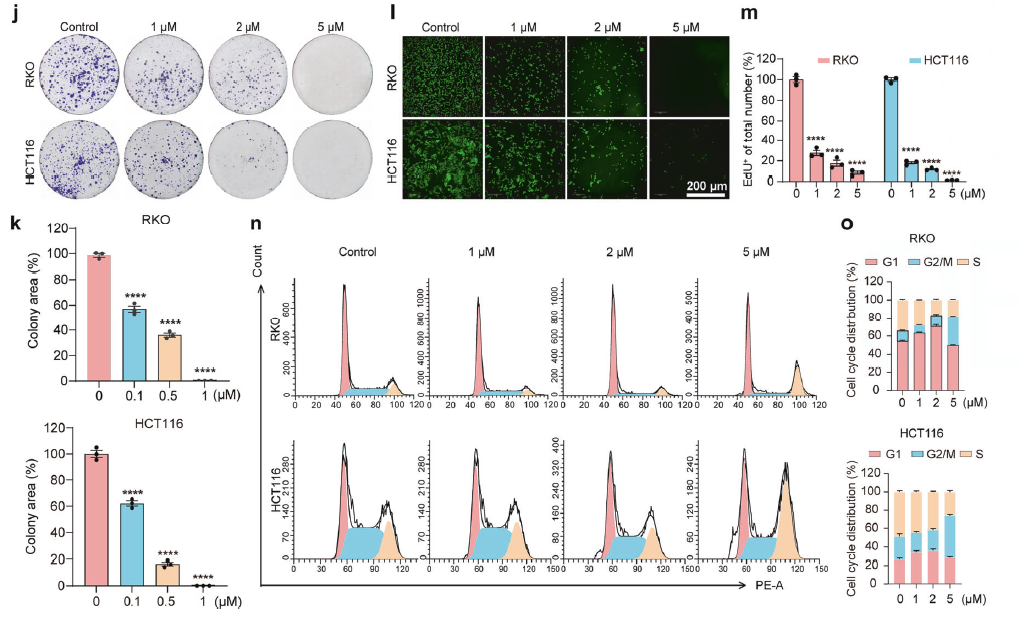
通过克隆形成实验、EdU实验、流式细胞术(细胞周期、细胞凋亡)等方法,证实ACE能抑制细胞增殖、诱导G2/M期阻滞和细胞死亡。同时发现它还能抑制肿瘤迁移(划痕实验)和克服耐药。
第二步
提出假说——ACE诱导的细胞死亡可能是铁死亡
思路:
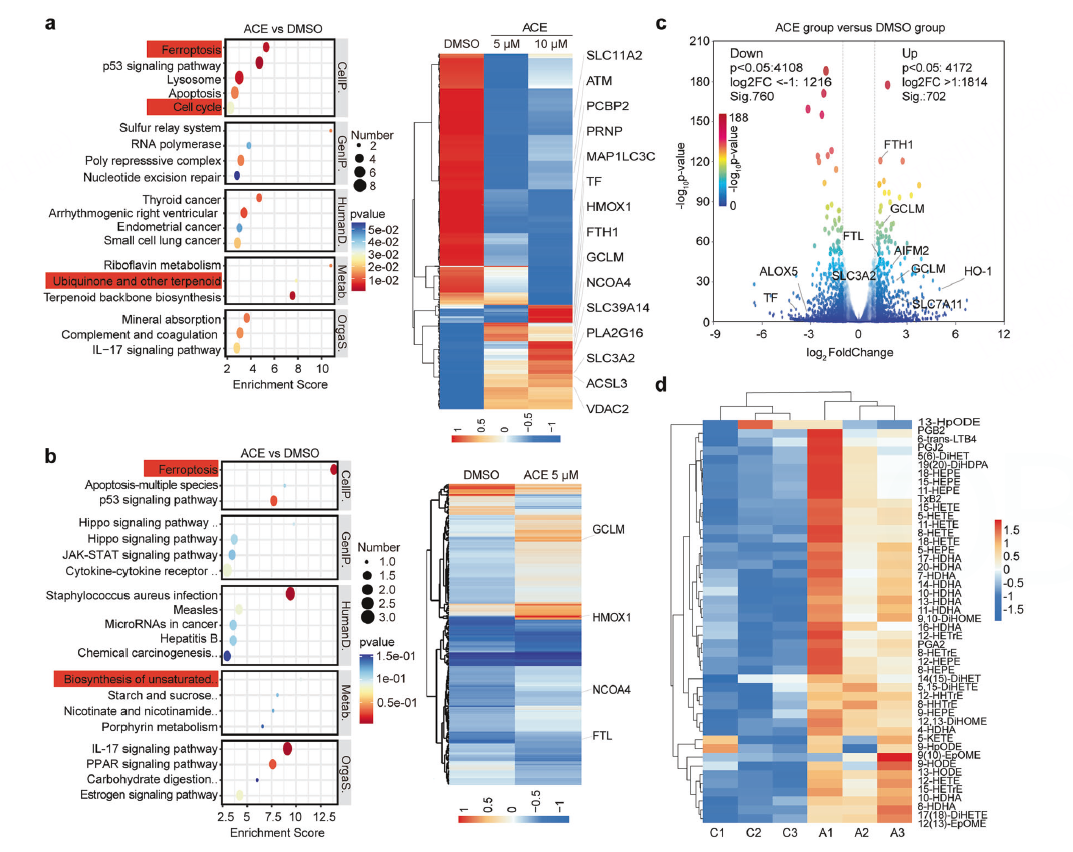
既然经典的凋亡通路未被激活(Caspase-3无变化),那么ACE可能通过其他非凋亡的细胞死亡方式起作用。利用组学技术来寻找线索。
方法:
多组学分析
对ACE处理的细胞进行蛋白质组学、转录组学和代谢组学分析。
通路富集
KEGG和GO分析均指向“铁死亡”是变化最显著的通路。
抑制剂实验
使用各类细胞死亡抑制剂进行“拯救实验”。结果发现,只有铁死亡抑制剂(Fer-1, Lip-1, DFO)能显著逆转ACE的细胞毒性,而凋亡、坏死、自噬的抑制剂无效。
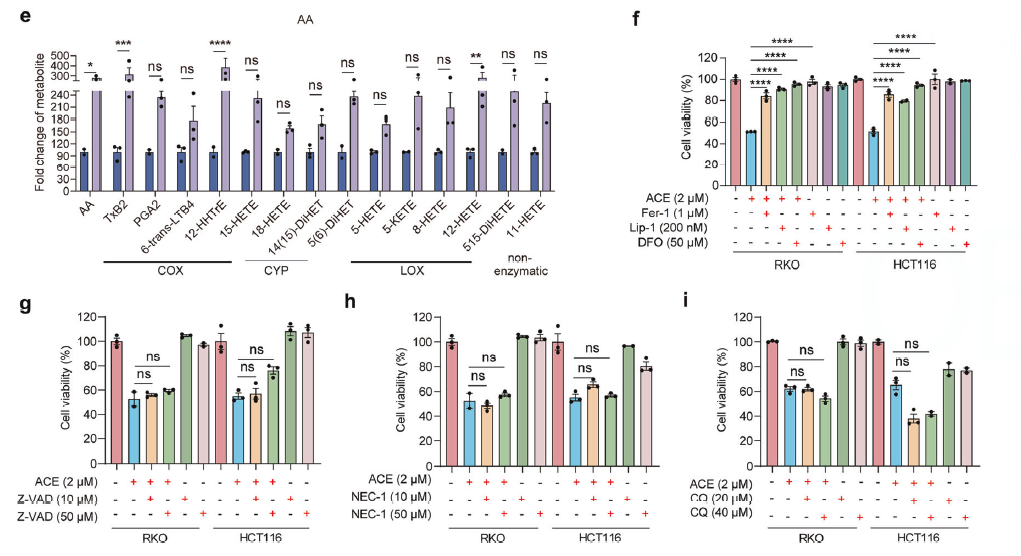
第三步
验证假说——证实ACE诱导了典型的铁死亡特征
思路:
全面检测铁死亡的几大核心生化指标:脂质过氧化、铁离子积累、ROS爆发和线粒体形态改变。
方法:
脂质过氧化检测
使用荧光探针BODIPY-C11和Liperfluo,以及MDA检测试剂盒,证明ACE能强烈诱导脂质过氧化物积累。
铁离子检测
使用荧光探针FerroOrange和亚铁离子比色法试剂盒,证明ACE能显著提高细胞内不稳定的二价铁离子(Fe²⁺)水平。
ROS检测
使用DCFH-DA探针,证明ACE诱导了ROS的爆发,且ROS清除剂(NAC)能部分挽救细胞死亡。
形态学观察
通过透射电子显微镜(TEM),观察到ACE处理后的细胞线粒体变小、膜密度增高、嵴减少,这是铁死亡的典型超微结构特征。
功能验证
使用Seahorse分析,发现ACE破坏了线粒体的呼吸功能。
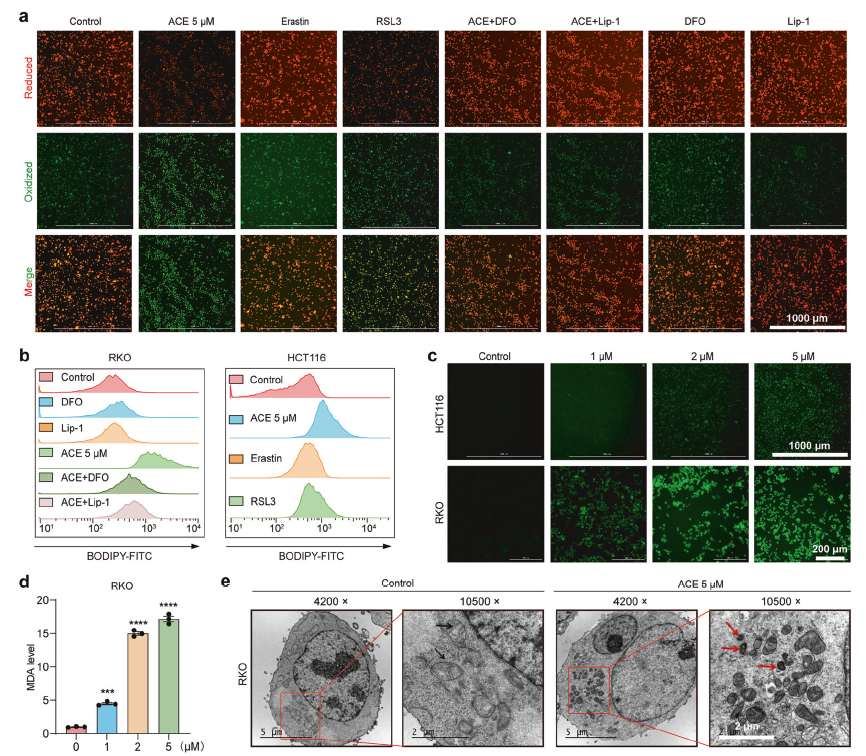
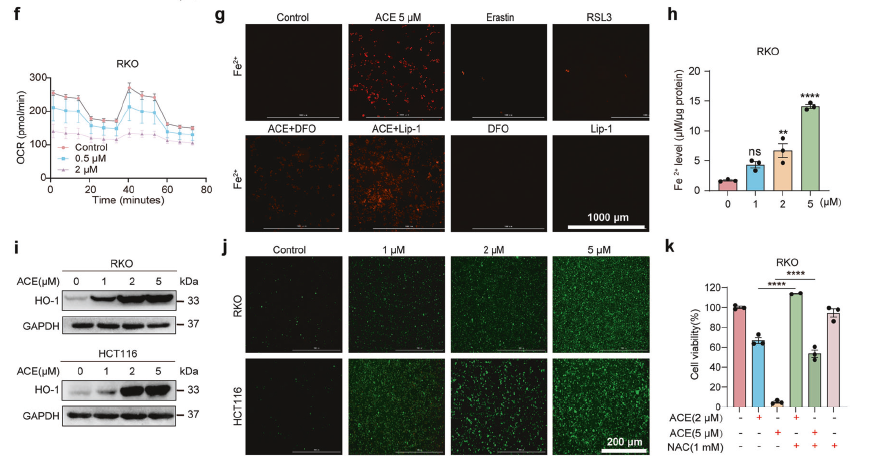
第四步
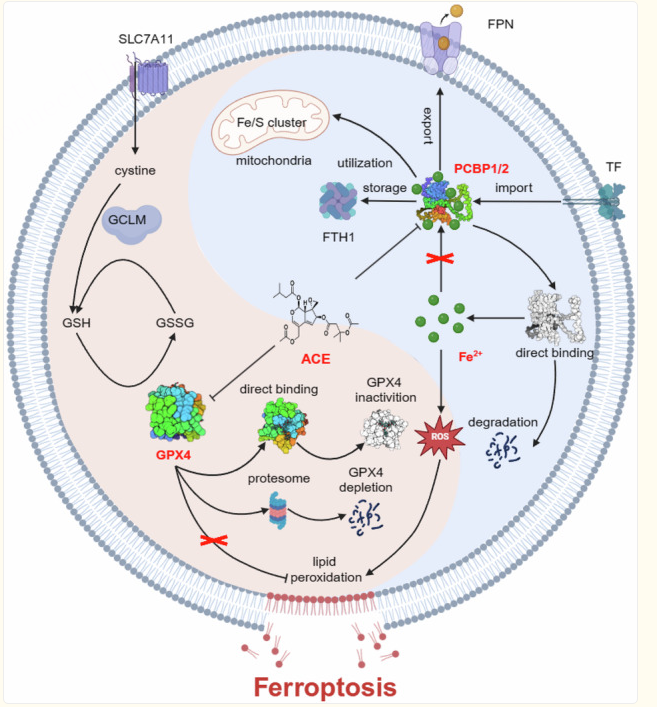
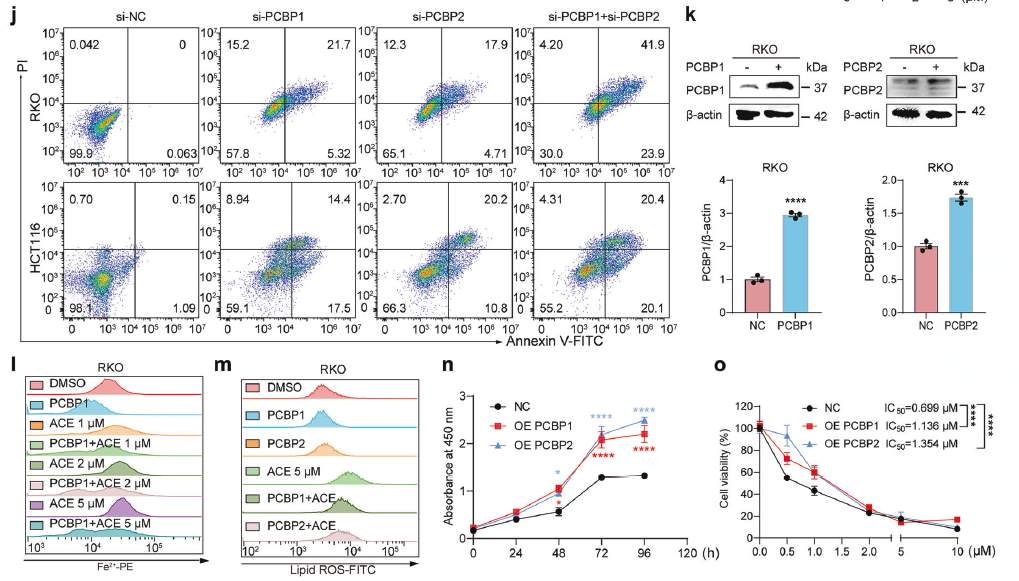
深入机制(上游)——ACE如何增加Fe²⁺?靶向PCBP1/2
思路:
Fe²⁺的快速升高是ACE的一个独特之处。组学数据显示HO-1上调,但实验排除了HO-1是早期Fe²⁺升高的原因。因此,寻找其他更直接的铁代谢调控蛋白。
方法:
靶点筛选
结合蛋白质组学和DARTS(药物亲和力响应靶点稳定性)技术,筛选出可能与ACE直接互作的蛋白,PCBP1/2两次都被富集到。WB验证了ACE能快速(1小时内)下调PCBP1/2蛋白水平。
功能模拟与挽救
敲低 (siRNA):敲低PCBP1/2能模拟ACE的作用,导致Fe²⁺和ROS升高,并诱导细胞死亡。
过表达 (Plasmid):过表达PCBP1/2能显著抵抗ACE诱导的Fe²⁺升高、脂质过氧化和细胞毒性。
直接结合验证
CETSA:证明ACE能改变PCBP1/2在细胞内的热稳定性,提示直接结合。
SPR:体外实验证明ACE与PCBP1有直接亲和力,KD值为0.8464 μM。
分子对接: 预测ACE可能与PCBP1/2的半胱氨酸残基(如Cys54)共价结合。
MST: 利用野生型和关键位点突变的PCBP1/2蛋白,精确证明了ACE与它们的直接结合,并确认Cys54是关键结合位点。
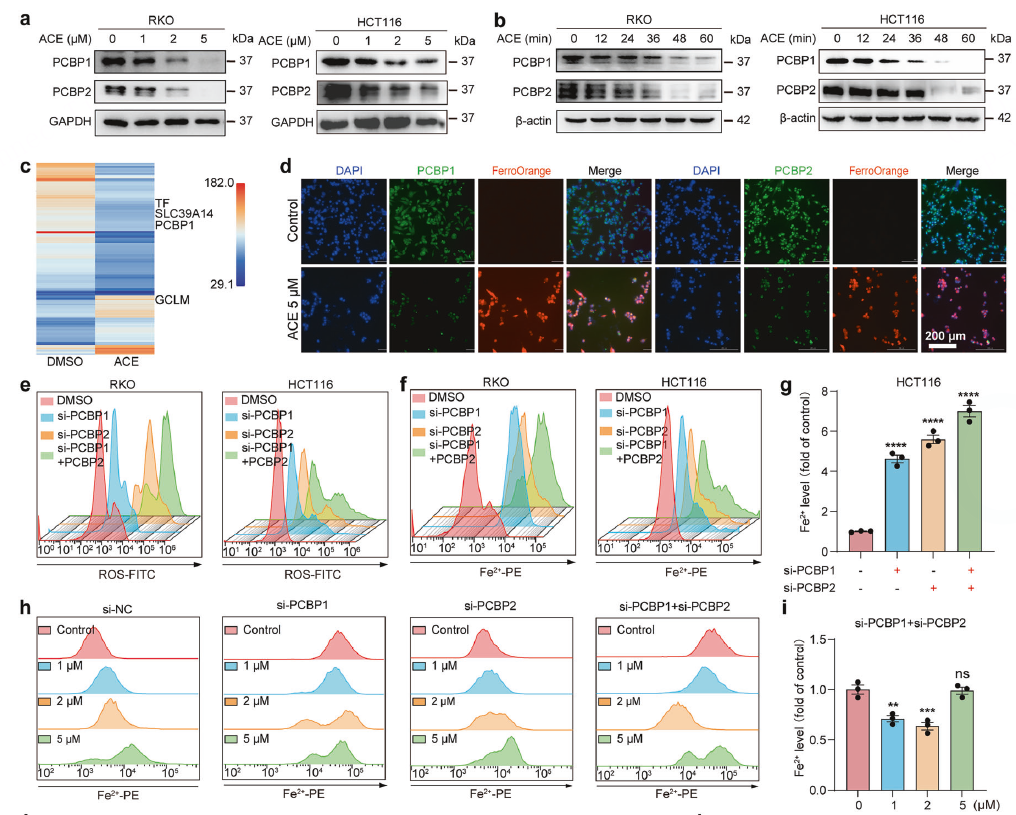
第五步
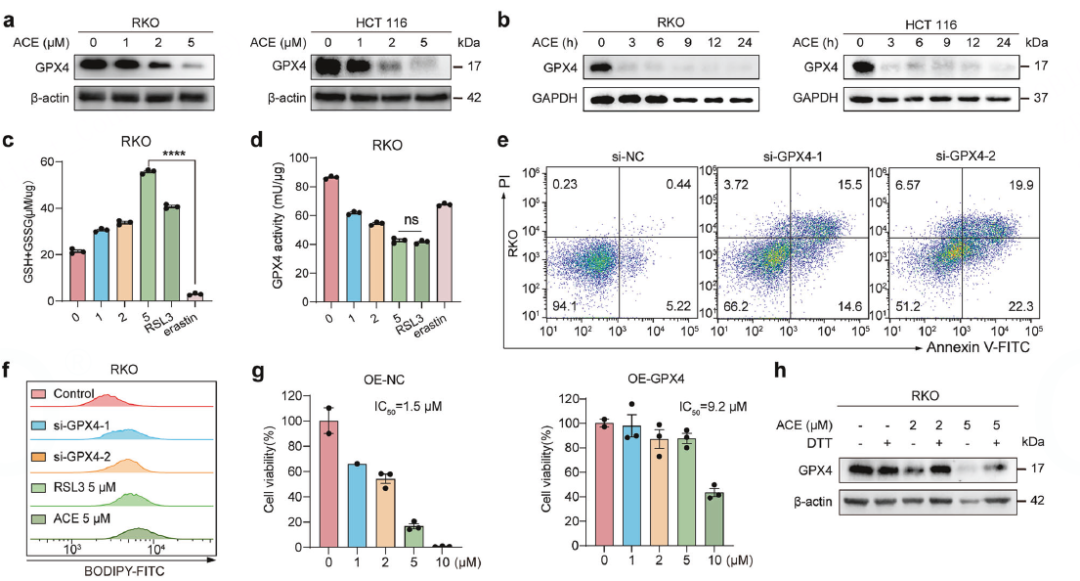
深入机制(下游)——ACE如何抑制抗氧化?靶向GPX4
思路:
作为一个铁死亡诱导剂,ACE很可能也作用于核心防御蛋白GPX4。
方法:
蛋白水平验证
WB证实ACE能剂量和时间依赖性地下调GPX4蛋白。
活性检测
酶活性实验证明ACE能直接抑制GPX4的活性,而不是通过耗竭GSH(GSH水平反而升高)。
功能模拟与挽救
敲低GPX4增敏,过表达GPX4耐药。
降解机制
通过CHX(蛋白合成抑制剂)和MG132(蛋白酶体抑制剂)实验,证明ACE促进了GPX4通过泛素-蛋白酶体途径的降解。IP实验进一步证实了GPX4的泛素化水平增加。
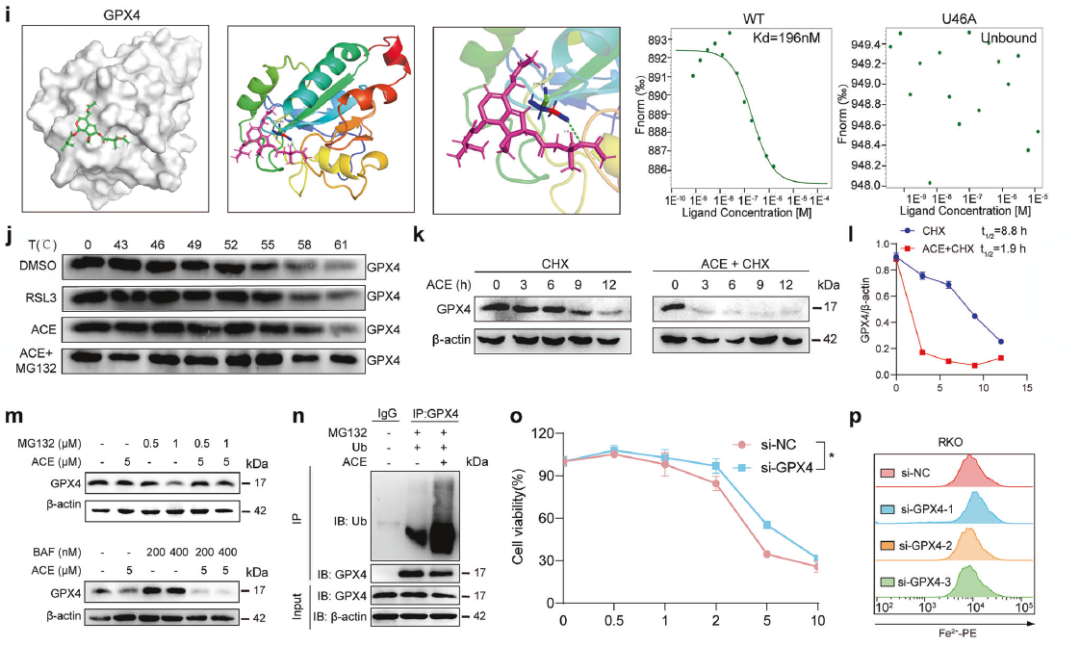
直接结合验证
同样使用CETSA、分子对接和MST,证明ACE直接结合GPX4,并锁定关键作用位点为硒代半胱氨酸(U46)。
第六步
体内验证与临床转化潜力评估
思路:
将体外发现的抗癌效果和机制在动物模型和更接近临床的模型中进行验证,并评估其安全性。
方法:
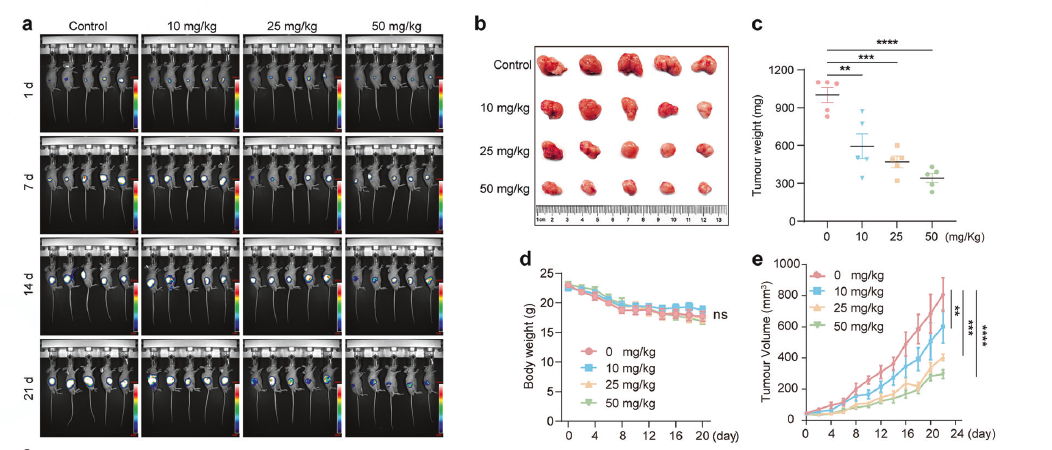
荷瘤小鼠模型
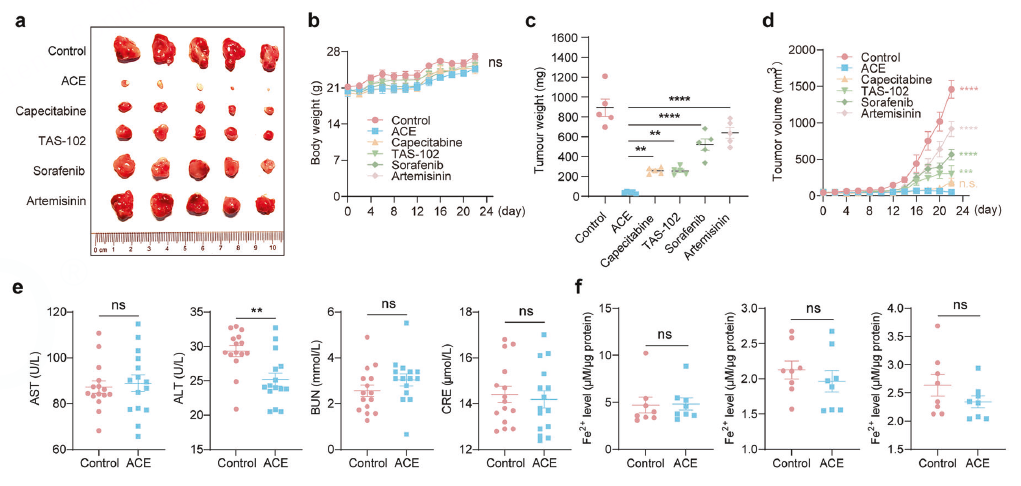
在两种结直肠癌细胞(HCT116-luc和RKO)的皮下移植瘤模型中,口服给予ACE。通过测量肿瘤体积、重量和生物荧光,证明ACE具有强大的体内抗肿瘤效果。
机制的体内验证
对肿瘤组织进行IHC染色和生化检测,证实ACE在体内同样下调了PCBP1/2和GPX4的表达,并上调了MDA和Fe²⁺水平。
药效对比
在动物模型中,将ACE与临床一线药物(卡培他滨、TAS-102)以及其他铁死亡诱导剂(索拉非尼)进行“头对头”比较,结果显示ACE的疗效更优。
安全性评估
对给药小鼠进行体重监测、主要脏器HE染色和血液生化指标检测,证明治疗剂量的ACE没有明显的毒副作用。
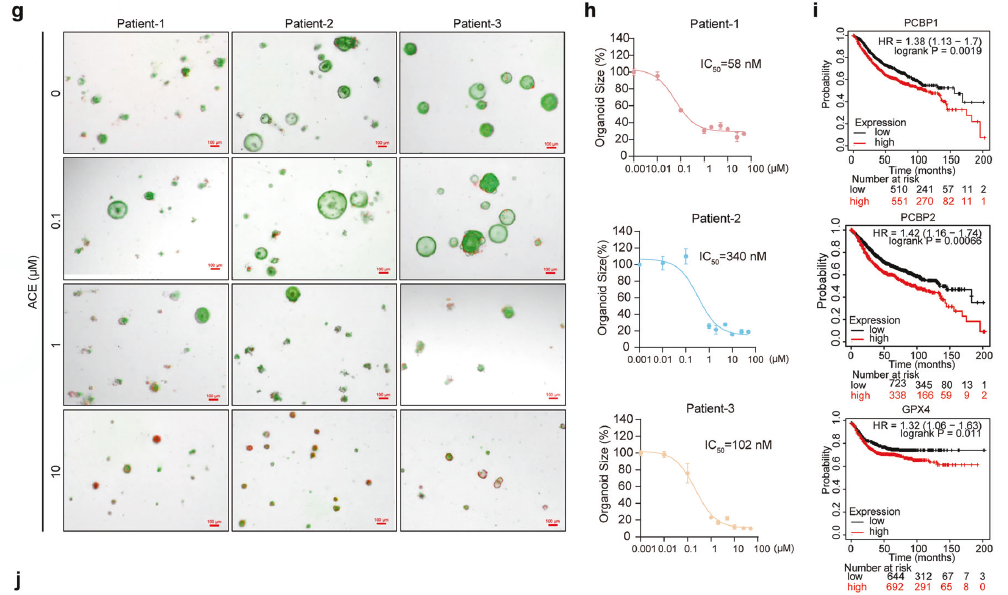
类器官模型
在人结直肠癌类器官上验证ACE的药效,发现其IC50值达到纳摩尔级别,显示出巨大的临床应用潜力。
临床样本关联
利用公共数据库(Human Protein Atlas)和临床病人样本的免疫荧光染色,证实靶点蛋白PCBP1/2和GPX4在结直肠癌组织中高表达,且与病人预后不良相关,为靶向治疗提供了临床依据。
假设您中标了一个类似的项目,比如“探索天然产物X通过诱导铁死亡治疗XX癌症的机制研究”,您可以借鉴这篇文章的思路,分阶段、有策略地推进您的课题。
业务咨询:15800353038









