和元生物技术(上海)股份有限公司品牌商
14 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
公司新闻/正文
Nature medicine | 揭示人类血管细胞的多样性和器官型特征
673 人阅读发布时间:2025-09-04 14:10
人体血管系统由内皮细胞(EC)和壁细胞组成,覆盖了体内广阔的表面积,在血液和组织环境之间提供了关键的界面。特定血管床之间存在功能差异,但它们在组织中的分子决定因素在很大程度上仍然未知。
近期在nature medicine上发表题为“An organotypic atlas of human vascular cells”的研究。作者整合了来自19个人体器官和组织的单细胞转录组学数据,并定义了42种血管细胞状态,包括从大口径血管到小口径血管沿动脉内皮轴的血管型过渡特征。作者还对器官型人群进行了表征,包括脾脏沿岸和血脑屏障EC,从而阐明了这些重要细胞状态的分子特征。内皮-壁细胞的串扰分析揭示了与Notch、Wnt、视黄酸、前列腺素和细胞粘附信号相关的血管型和器官型通信通路。转录因子网络分析揭示了组织特异性模块中下游靶基因的差异调节,例如FOXF1在多个肺血管亚群中的差异调节。此外,对不同血管床内的血管药物靶点进行了机制推断。该项研究增强了对人类血管细胞中血管多样性和器官型分子特征的理解,并对跨组织的血管疾病具有治疗意义。
关键研究结果
1 人体血管系统的多器官图谱
为了表征健康成人血管细胞异质性,整合了来自 19 个器官和组织的单细胞数据集(图1a)。确定了主要的细胞类型,包括内皮细胞、壁细胞、上皮细胞、成纤维细胞、免疫细胞和肌肉卫星细胞(图1b-c)。EC 通过CDH5、VWF和PECAM1的表达来定义。壁细胞表达 VSMC 和周细胞标记物PDGFRB、NOTCH3、ACTA2、MYH11和RGS5,以及收缩调节标记物肌球蛋白轻链激酶 ( MYLK ) 和 leiomodin-1 ( LMOD1 ) 。还发现了 EC 和壁细胞之间的共同特征,包括TINAGL1编码的整合素和 EGFR 结合分子,以及ESAM(内皮细胞特异性粘附分子)(图1c)。smFISH证实了EGFL7定位于 EC、MYLK定位于 VSMC 、及TINAGL1在两者中表达(图1d、e)。
为了探索血管细胞的异质性,对内皮细胞和壁细胞进行了亚群分析,获得了大约 67,000 个细胞,并鉴定了动脉、毛细血管、静脉和淋巴管 EC、周细胞和 VSMC(图1f、g)。与先前的研究结果一致,区分小鼠动脉(Efnb2)和静脉(Ephb4、Vwf 和 Nr2f2)EC 的典型标志物在人类中几乎没有血管型特异性。为了确定来自不同血管EC 的相似性,根据器官对动脉、毛细血管和静脉 EC 进行了层次聚类。结果表明,细胞表型与血管型身份(动脉 vs 毛细血管 vs 静脉)有很大相关性(图1h)。
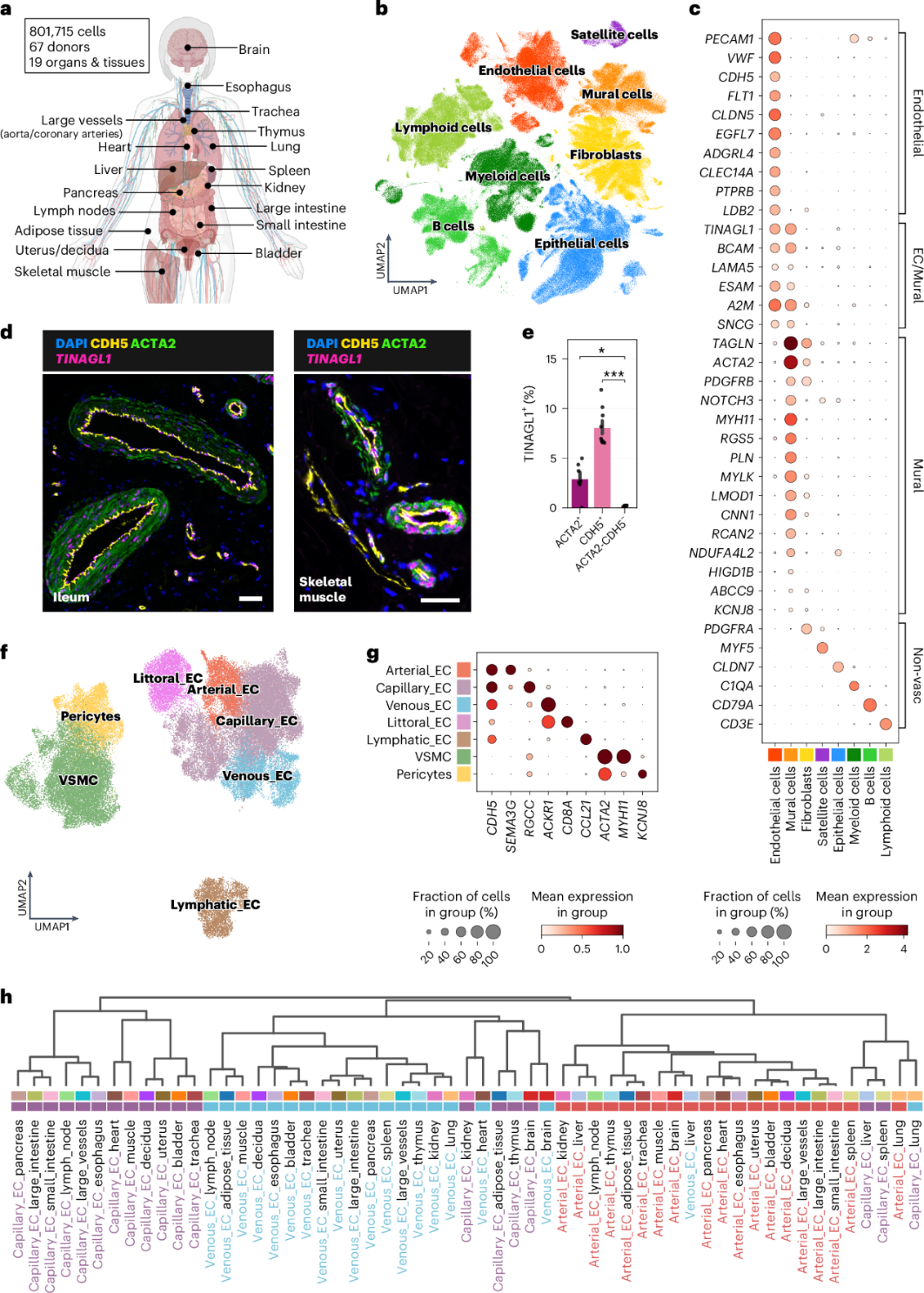
图1多器官血管细胞图谱概览
2 动脉 EC 表现出过渡特征
2.1动脉EC的血管型特异性
在动脉 EC 中,鉴定出三种血管型细胞状态,包括来自主动脉和冠状动脉的细胞簇 (aorta_coronary_ec) 和两个跨组织共享的群体 (art_ec_1 和 art_ec_2) (图2a、b )。Aorta_coronary_ec 和 art_ec_1 表达BGN、ELN和SULF1 (图2c )。此外,art_ec_1 和 art_ec_2 显示来自 Notch 通路、 HEY1和DLL4 以及SEMA3G的血管稳态调节剂等相关基因的表达。相反,aorta_coronary_ec 富含亮氨酸的小蛋白聚糖 (SLRP) OGN和OMD以及糖蛋白EFEMP1。此外,art_ec_2 表达NEBL和毛细血管标记物GPIHBP1,表明存在中间小动脉表型(图2c)。
亚细胞水平的定性探索和基因相关性证实了SULF1在动脉 EC(GJA5和SEMA3G)中特异性表达,而在静脉 EC(ACKR1、SELE和PLVAP)中不存在(图2d-f)。为了进一步证明三种动脉 EC 状态沿分化轴存在,进行了轨迹推断。显示从 aorta_coronary_ec 到 art_ec_1、art_ec_2 和 capillary_ec 的分区,沿分化轴的SULF1表达降低,而NEBL在 art_ec_2 中达到峰值(图2h、i)。表明动脉 EC 具有跨器官的共同特征和沿动脉轴的不同表达。
2.2动脉 EC 的器官型特异性
鉴定了四种器官型动脉 EC,如肺 (pul_art_ec)、脑 (brain_art_ec)、肾 (kidney_art_ec) 和脾 (spleen_art_ec) (图2a,b )。Pul_art_ec 表达编码血管舒张介质的基因,包括NPR3和VIPR1,以及NOS1 。Wnt抑制剂DKK2在 pul_art_ec 和brain_art_ec中表达。Kidney_art_ec 表达SLC6A6、PI16以及血管舒张调节剂CHRM3和KCNN3。spleen_art_ec 的特征为凝血因子的富集,包括SERPINA5、GP9和 NOX5 (图2a-c)。
2.3静脉 EC 表现出共享和器官型特征
表征了四种静脉 EC 群,其中ven_ec_1存在于大多数器官中,并表达ACKR1、POSTN和PLVAP。ven_ec_2在骨骼肌、脂肪组织和淋巴结中富集,并表达ICAM4和SELE (图2a-c )。pul_ven_ec (肺) 表达HDAC9和IL7R。pul_ven_ec 和brain_ven_ec 共同表达前列腺素相关的PTGDS和PLA1A,而brain_ven_ec表达G 蛋白偶联受体ADGRL3和SH3RF3。
2.4淋巴 EC表现出器官型特征
淋巴内皮细胞 (LEC) 与血液内皮细胞不同,它们携带淋巴液,显示出独特特征,表达PROX1、LYVE1和PDPN。LEC 包含 7 个亚群,TFF3在所有器官的 cap_lec 中均有表达。因此,可探索 TFF3升高作为转移的潜在预测因子。
2.5脾脏EC 具有共同的静脉和淋巴 EC 特征
脾脏脉管系统由一个开放的循环组成,其中开放的小动脉流入红髓,红细胞通过脾静脉窦过滤。Littoral_EC特征是表达泛 EC 标志物PECAM1和VWF(图2j)。SCENIC 用于预测脾脏 EC 中细胞状态特异性转录因子和下游靶基因。NR5A1成为 littoral_ec 和 spleen_art_ec 中的共同转录因子(图2c 、j)。值得注意的是,NR5A1对小鼠脾脏血管发育和红细胞过滤至关重要,突变会导致人类无脾,这意味着它在脾脏血管稳态中起关键作用。这些结果突出了脾脏血管细胞间的器官型特征。
2.6推断动脉、静脉和心内膜 EC 中的药物靶点
Drug2cell是一种利用已知药物-蛋白质相互作用的计算机药物筛选工具,用于预测不同血管床中的潜在细胞药物靶点。发现SELP存在于主动脉、冠状动脉和肺动脉 EC 以及静脉和心内膜 EC 中(图2k),而 P-selectin (encoded by SELP)是人源化单克隆抗体抑制剂 crizanlizumab 的靶点。这些数据表明,尽管 crizanlizumab 用于预防镰状细胞病中的微血管闭塞,但可扩展到其他血管疾病。此外,CHRM3是 M3R 激动剂的靶点,用于治疗青光眼、眼高压和口干症,以及拮抗剂雷芬那辛和阿地溴铵的靶点,用于治疗慢性阻塞性肺病;在这里表明肾脏、主动脉和冠状动脉 EC可能成为其靶点。EC 的血管型和器官型多样性的定义提供了对细胞特异性药物靶点的见解,突出了药物重新利用的候选药物,并将机制推论与特定细胞状态联系起来。
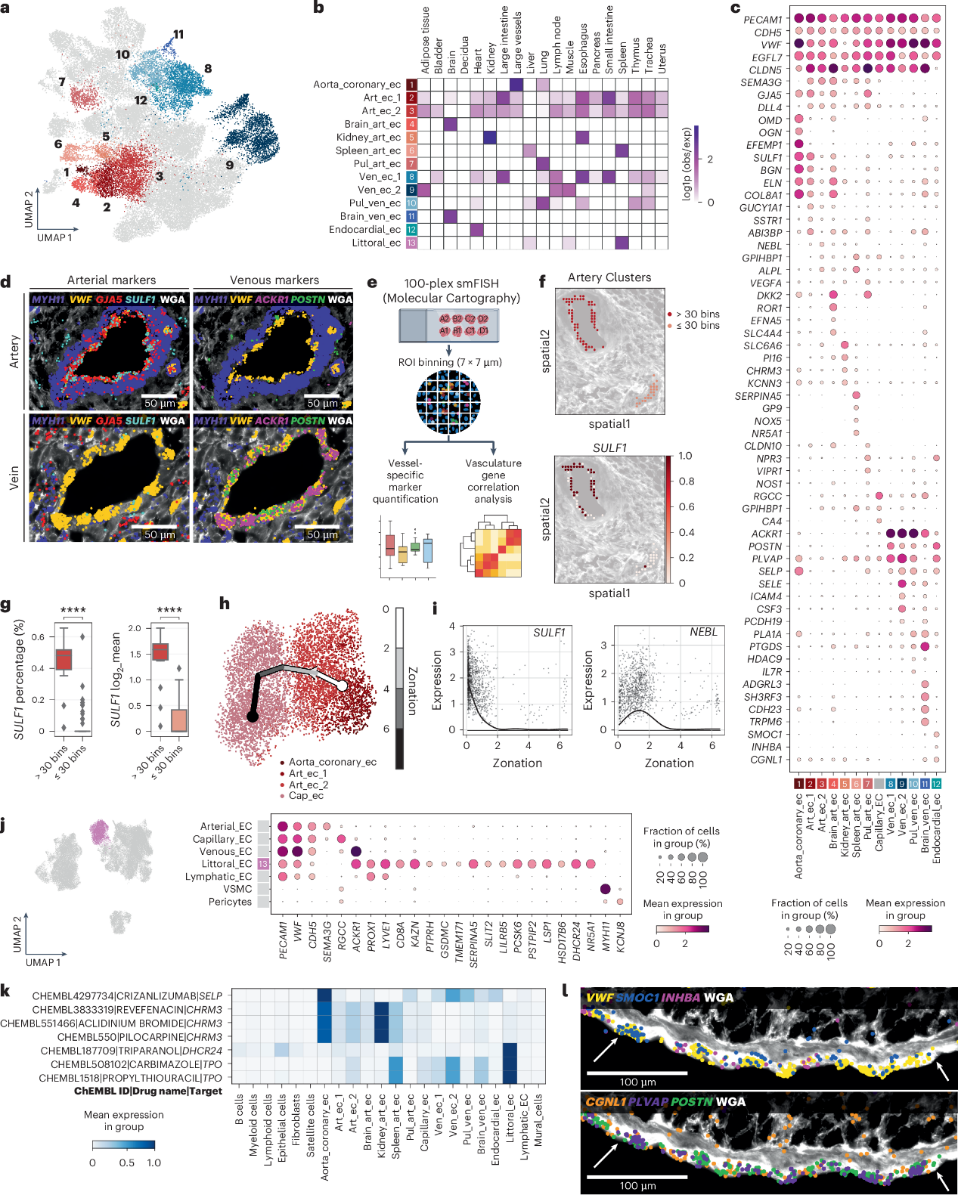
图2跨组织动脉和静脉的内皮异质性
3 微血管 EC 的器官型特化
3.1肌肉和脂肪微血管 EC 中的脂肪酸代谢
Capillary ECs 被细分为 12 种状态,其中cap_ec表现出大多数器官共享状态,其余则表现出器官特异性 (图3a、b )。仅限于心脏和骨骼肌 (myo_cap_ec) 的群体表达脂肪酸吸收至关重要的基因,表明其有助于满足肌肉组织的高能量需求。FABP4和FABP5 (编码脂肪酸结合蛋白) 以及转录因子MEOX2和TCF15 (图3b-e ),可诱导CD36 和LPL (脂蛋白脂肪酶) 以促进脂肪酸跨 EC 运输。此外,富含脂肪组织的EC (adip_cap_ec) 具有相同的特征并表达ACACB和脂肪形成的PPARG (图3a-d )。
3.2肺微血管 EC 的三种细胞状态
定义了三种肺微血管 EC 群,包括aerocyte_ec、pul_cap_ec和pul_tip_cap_ec(图3a-c)。Pul_cap_ec表达IL7R和FCN3,pul_tip_cap_ec表达EDNRB、CA4、SOSTDC1和前列腺素相关的HPGD (图3c )。SCENIC显示FOXF1是所有肺 EC的调节因子,具有共同和细胞状态特异性的下游靶标(图3f),这表明相同的转录因子可以调节具有血管型和器官型特异性的下游靶标。pul_tip_cap_ec 表达血管生成尖端细胞标志物PGF、CXCR4和ESM1,及CYTL1,表明 pul_tip_cap_ec 是一群具有血管生成潜力和/或内皮祖细胞状态的细胞群体。
3.3肾小球 EC 表现出独特的分子特征
肾脏富含两种微血管 EC 群:glomeruli_ec 和 kidney_cap_ec(图3b)。肾小球 EC 表达EHD3和MEG3(图3c)。Glomeruli_ec 表达硬化蛋白(由SOST编码)(图3c),这是一种 Wnt 抑制剂,可减少小鼠的骨形成并防止血管钙化。巧合的是,肾小球中的钙化很少见,这表明肾小球SOST可以防止钙化。Drug2cell 预测肾小球 EC 是 romosozumab 的靶点,romosozumab 是一种用于治疗骨质疏松症的 SOST 抑制剂(图3i)。
3.4肝毛细血管 EC 群体分区
确认存在两种肝窦毛细血管内皮细胞群,包括门脉周围(periportal_cap_ec)和中心周围(pericentral_cap_ec)内皮细胞。pericentral_cap_ec富集了编码 C 型凝集素(CLEC1B、CLEC4G和CLEC4M)和凝集素途径纤维胶原蛋白(FCN2 和 FCN3)的基因(图 3c),这些基因与补体级联和免疫调节有关。相反,periportal_cap_ec 富集了广泛表达于其他器官血管床的标志物(MGP、AQP1和CLEC14A)和毛细血管内皮细胞标志物RGCC。根据CD4表达,drug2cell 将肝窦 EC 鉴定为抗 CD4 单克隆抗体 ibalizumab 的假定靶点 (图3c,i )。SCENIC 揭示了编码调节肝毛细血管 EC 的转录因子,包括FOXN2、EGR2和NFATC1,其中MAF、NR2F1和GATA4在中枢周围 EC 中转录活性更高 (图3g,h )。总之,证明了器官型微血管 EC 显示出与组织功能相关的转录特征。
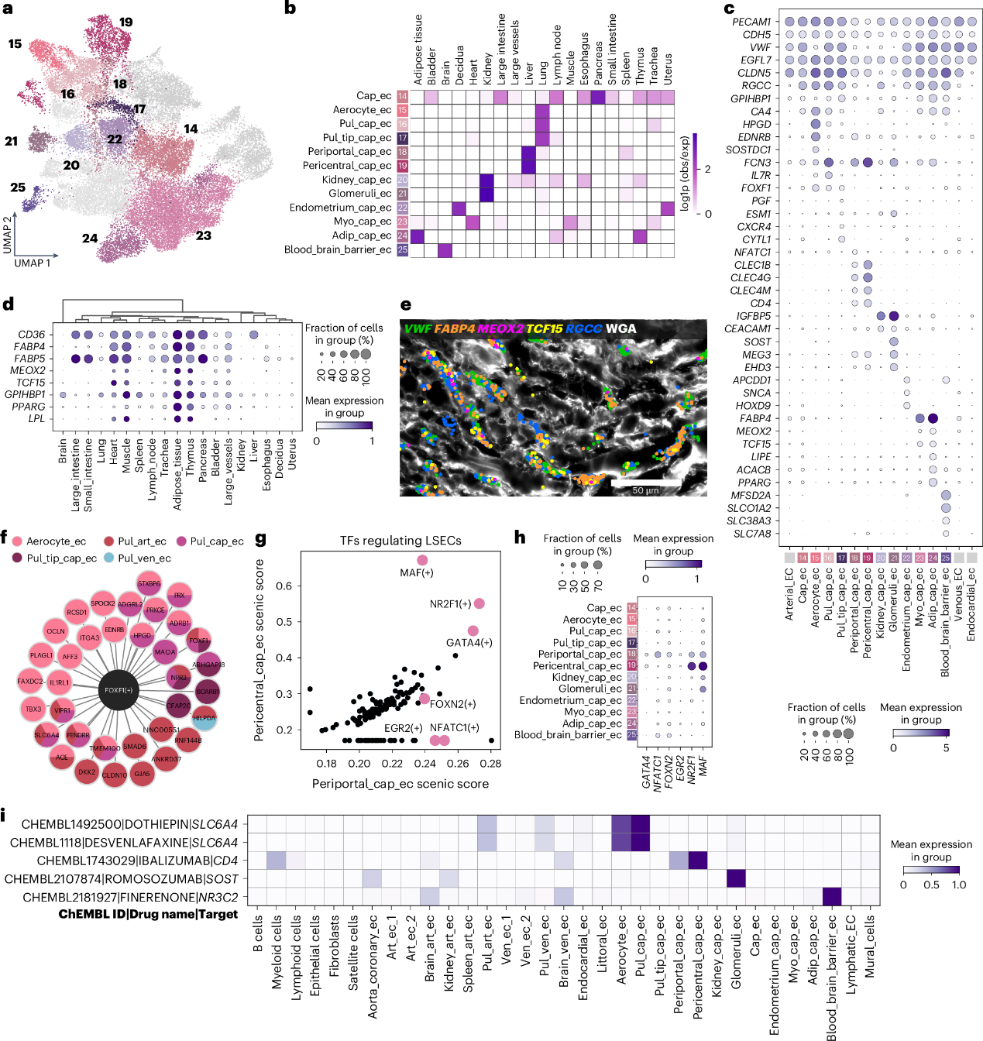
图3 微血管的内皮异质性
4 VSMC 和周细胞表现出血管型特征
VSMC 形成动脉和静脉的肌肉层,动脉壁较厚,可承受较高的血压。此外,周细胞形成围绕毛细血管的不连续层,为微血管提供至关重要的稳态和功能支持。跨器官的周细胞和 VSMC 的层次聚类在很大程度上证明了这两个细胞的转录相似性(图4a)。确定了 10 个 VSMC 和周细胞群(图4b-d)。art_smc的特点是表达RERGL,CASQ2(与钙储存相关并可能调节血管收缩)及钾通道KCNAB1(图4d)。smFISH 证实RERGL在动脉 VSMC 内表达,而在静脉 VSMC 中不存在(图4e、f)。值得注意的是,aorta_coronary_smc与内皮细胞一样表达 ECM 编码基因ELN、OGN和OMD(图2c和4c、d),有助于壁结构和机械感应。ven_smc富含 ECM 相关的HMCN2和FLNC(细丝蛋白 C)。
在周细胞中,cap_pc由多器官共享,其特征是表达ABCC9、KCNJ8和RGS5,缺乏泛 VSMC 标志物MYH11 (图4c、d )。smc_pc_intemediate表现出周细胞和 VSMC ( PDGFRB、ACTA2和MYH11 ) 的特征 (图4d ),表明其处于中间状态;此外,还表达STEAP4。smFISH 显示静脉MYH11 +细胞与动脉 VSMC 相比具有更高的STEAP4表达,表明在静脉周围的存在可能性更高(图4g、h)。
蜕膜和子宫也包含独特的周细胞和 VSMC 群(uterine_pc 和 uterine_smc)(图4b、c)。Uterine_pc 表达干扰素信号标志物(IFI6和IFI27)和LUM(lumican)(图4d)。与子宫毛细血管 EC 类似,uterine_smc 表达 Wnt 抑制剂编码基因APCDD1(参与血管重塑),及HOPX和NREP(图3c和4d)。脑动脉平滑肌细胞 (brain_art_smc) 表达动脉平滑肌细胞标志物、PDE4D(通过血管紧张素-2介导平滑肌细胞收缩),及SIK3(调节平滑肌细胞增殖) (图4c、d )。研究表明壁细胞之间存在异质性,动脉和静脉之间的血管型平滑肌细胞特征不同,肺、脑、子宫和蜕膜中的器官型群体也不同。
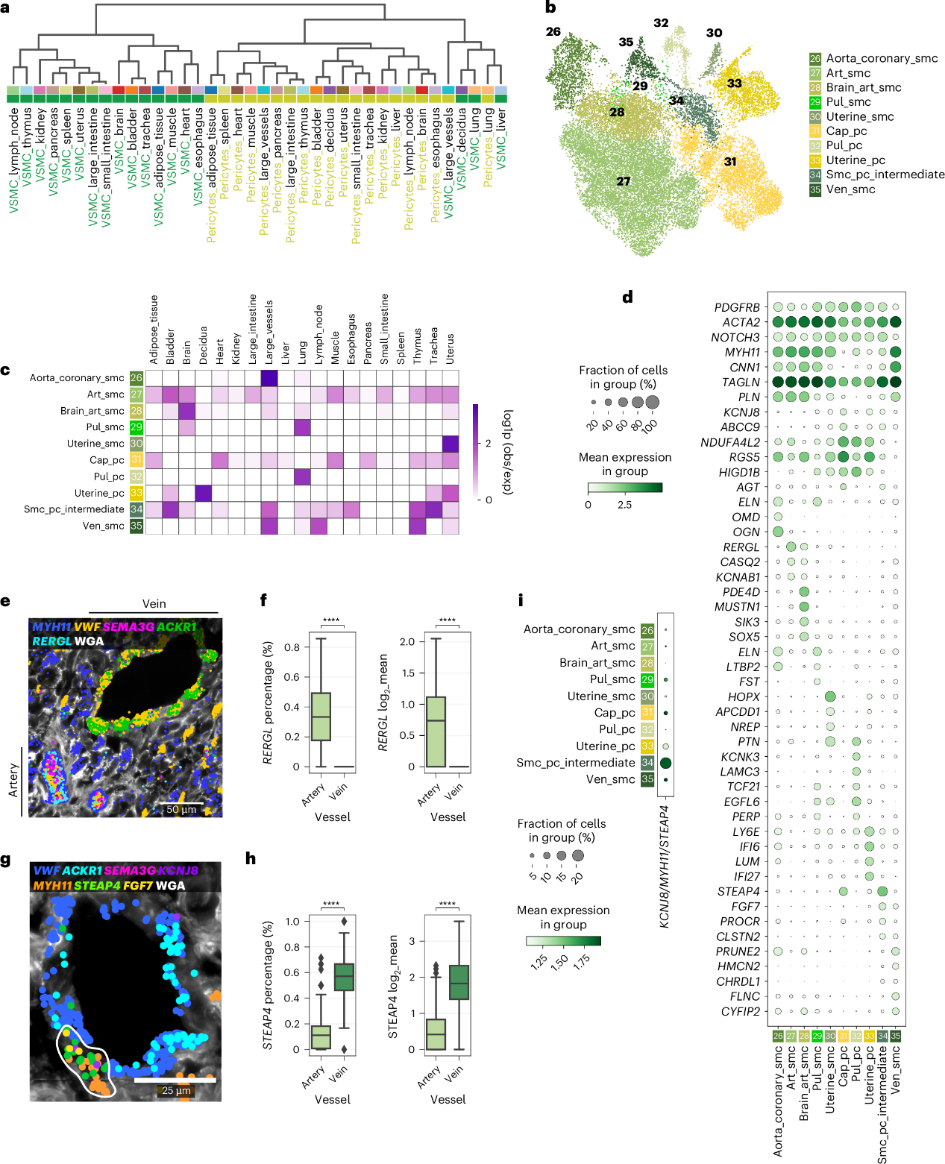
图 4周细胞和 SMC 的异质性
5 血管型和器官型 EC–壁细胞间的信号传导
利用心脏组织的空间转录组来绘制可能相互作用的血管细胞。证实了预期一致的细胞与细胞共定位,如动脉 EC 与动脉 VSMC、毛细血管 EC 与周细胞以及静脉 ec_1 在静脉区内,而 smc_pc_intermediate 则存在于动脉和静脉微环境。
血管型相互作用包括心脏和淋巴结中从 art_smc 到 art_ec_2 的 VEGFA–VEGFR1、VEGFA–VEGFR1/2、VEGFA–VEGFR2信号传导(图5a 、b),表明其通过调节 EC和血管舒张在维持动脉稳态中发挥作用。从 art_ec_2 到 art_smc 的 VEGFA–NRP1 信号传导在心脏动脉中富集,这对于小鼠的血管发育和VSMC 功能至关重要。从动脉内皮细胞(art_ec_1)到大肠中的 VSMC 会有视黄酸 (RA) 信号传导(图5a、c),表明 RA 除了在血管发育中的作用外,还在维持肠动脉稳态方面具有器官型功能。
WNT5A 依赖性信号在子宫内膜毛细血管中富集,EC 和周细胞上表达特定受体(图5d、e)。鉴于 WNT5A 在组织修复中的作用,推测这种信号有助于月经周期期间子宫组织重塑。与 WNT5A 相比,WNT6 信号仅限于周细胞和内皮细胞,并且在多种组织中更为广泛。前列腺素是脂质衍生的信号分子,在疼痛和炎症中起着重要作用。通过绘制PGE2和相应的前列腺素 E 受体基因(PTGER1和PTGER3)之间的作用,发现这种信号在胰腺毛细血管内皮细胞和周细胞中富集。相反, PTGER4信号在肌肉、脂肪组织和胸腺毛细血管 EC 中富集(图5f、g)。总体而言,微血管相互作用表现出血管型和器官型差异,暗示其对微环境的适应。
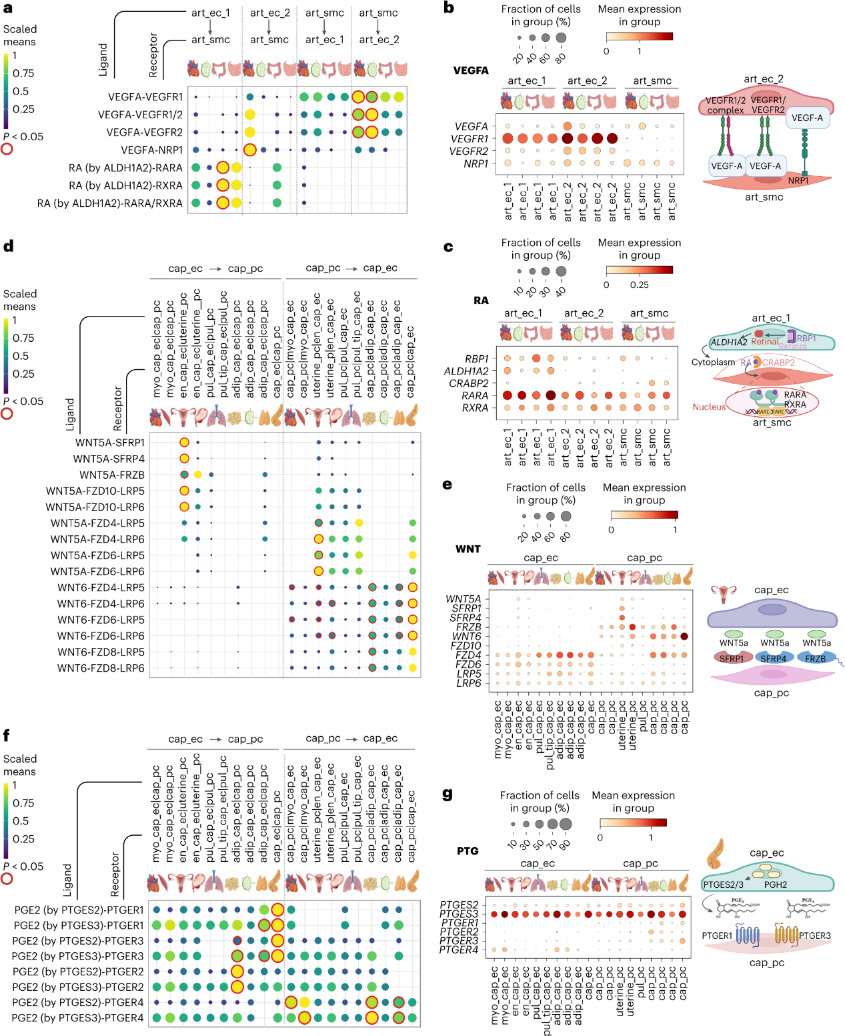
图 5 EC 和壁细胞之间的器官特异性信号传导
和元服务
和元生物提供多组学服务(如转录组、Astral蛋白组、非靶向代谢组、表观组和微生物组等)和时空组学服务,如单细胞转录组测序(10x、墨卓等多平台scRNA-seq /snRNA-seq)和空间转录组测序(10x Visium、10x CytAssist、10x Visium HD、10x Xenium),助力您的科研研究!
业务咨询









