和元生物技术(上海)股份有限公司品牌商
13 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
公司新闻/正文
【肝脏篇】单细胞及空间多组学新研究汇总
744 人阅读发布时间:2025-09-03 17:04
从2020年至今,肝脏单细胞多组学通过技术创新与多学科交叉,在解析肝脏病理机制、发现治疗靶点及预测疾病模型等方面取得了一些创新性进展。截止目前,在Pubmed中共检索到1271篇,从2020年到2025年共发表了745篇(其中10分以上的为155篇,占比为21%),从这里可以看出,该领域研究热度依然不减。
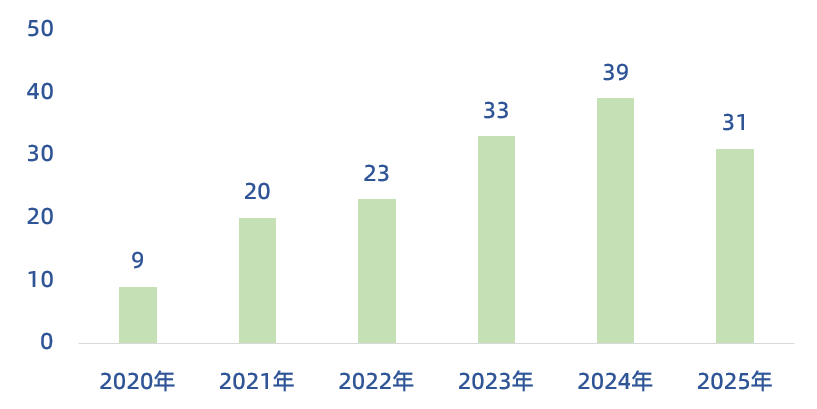
(手动统计整理,可能会有微小出入啦)
总体来说,聚焦于以下几方面:
1.时空组学与多组学整合
如构建高精度时空图谱、单细胞多组学技术创新。单细胞空间蛋白质组学在单个肝细胞中鉴定到 3926 种蛋白,且蛋白呈现区域化表达。
2.从稳态到疾病的全景解析
【肝脏稳态与发育】单细胞时序分析显示,出生后肝细胞经历从增殖到功能成熟的动态过程,Scd2 作为新生儿肝细胞特异性基因,参与单不饱和脂肪酸合成。【肝再生机制】时空数据显示,再生过程中肝脏分区特征保持但代谢功能下调,中央静脉区域 Wnt 和 NF-κB 通路激活,门静脉区域 IL6 通路主导。
3.疾病机制与细胞互作
【肝癌】鉴定出10种肝细胞亚型,包括恶性 Hep2 和免疫抑制型 Hep9。【肝硬化】TREM2+CD9+巨噬细胞通过 PDGFR 和 NOTCH 信号促进纤维化,而 ACKR1+PLVAP+内皮细胞增强白细胞跨膜迁移。
4.治疗靶点开发
【免疫调控】靶向单核来源巨噬细胞(如阻断 Ccr2)可减少纤维化;IL-8/CXCR1 轴抑制剂在酒精性肝炎中显示疗效。【代谢干预】Mas信号激动剂通过抑制 MYC+CD63+内皮细胞与 MMP12+巨噬细胞互作,减轻药物性肝损伤。【肿瘤治疗】针对HCC亚型的个性化用药和 Wnt 通路抑制剂(如 LGK-974)进入临床前验证。
未来,随着单细胞空间多组学技术的进一步发展,以及临床转化研究的深入,肝脏疾病的精准诊疗有望迎来新的变革。具体有哪些新研究,接着往下看啦!
研究一
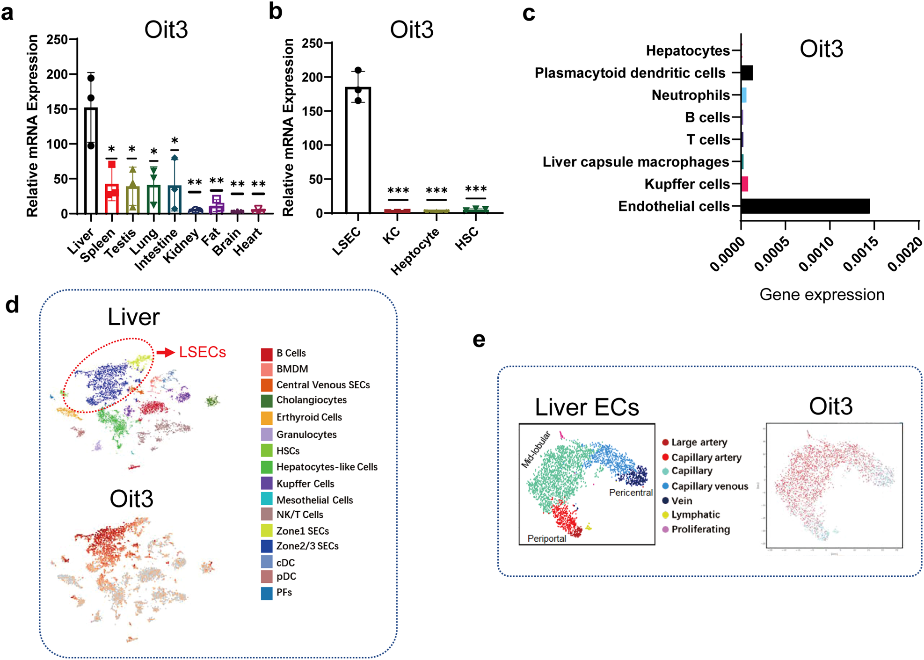
空军军医大学王琳团队发现一种有前途的靶向肝窦内皮细胞的标志性基因OIT3
文章标题:Oit3, a promising hallmark gene for targeting liver sinusoidal endothelial cells
发表期刊:Signal Transduction and Targeted Therapy(IF 52.7)
发表时间:2023年
技术手段:单细胞 RNA 测序(scRNA-seq)
肝窦内皮细胞(LSECs)是位于肝窦内的高度分化的内皮细胞,在维持肝内皮细胞区域的稳态中发挥关键而不可或缺的作用。单细胞测序为肝血窦内皮细胞的Marker鉴定提供了有力的工具。基于Kaljcka等人建立的内皮细胞单细胞转录组图谱,分析了LSECs的表达模式,发现了18个基因同时属于肝脏特异性EC的Top50和肝脏特异性毛细血管内皮的Top50,且在这18个基因中,只有Adam23、Clec1b、Dnase1l3和 Oit3表现出显著的肝脏特异性表达。进一步分析发现,在胚胎第14天(E14)、E14.5、E18或成年鼠的肝脏中观察到了Oit3高表达。有趣的是,Oit3+细胞的空间分布与肝窦内皮细胞完全吻合。这些数据表明:Oit3应该是LSECs的选标记基因。此外,该研究构建了诱导型Oit3驱动的CreERT2转基因小鼠。在Oit3-CreERT2-tdTomato小鼠肝脏中,tdTomato红色荧光与Lyve1、VE-Cadherin大部分共定位,证明了tdTomato对LSECs的成功标记。98.76%的tdTomato阳性细胞为CD31阳性,显示出良好分化的LSEC特异性疏孔状结构,且CD31、VE-Cadherin、VEGFR2和VEGFR3在tdTomato阳性细胞中明显富集。
该研究构建了Oit3驱动的CreERT2转基因小鼠并验证了其有效性,为探索LSECs在生理和病理状态下的复杂功能和机制提供了可靠的方法。
研究二
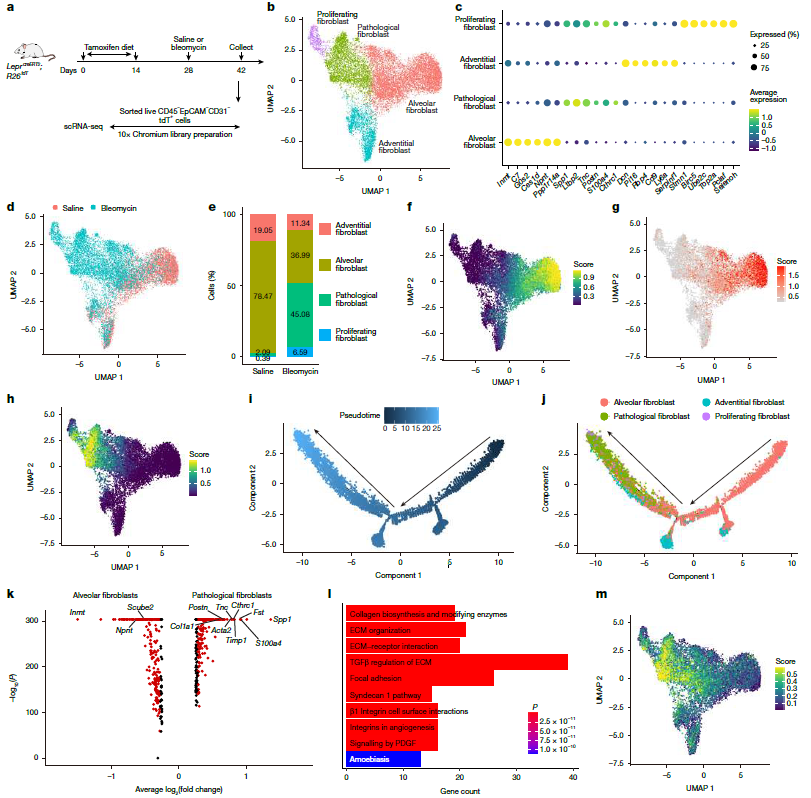
RUNX2通过肺泡成纤维细胞向病理性成纤维细胞的转化促进纤维化
文章标题:RUNX2 promotes fibrosis via an alveolar-to-pathological fibroblast transition
发表期刊:Nature(IF 48.5)
发表时间:2025年
技术手段:单细胞 RNA 测序(scRNA-seq)、scATAC-seq
肺纤维化是一种以肺泡结构破坏、细胞外基质过度沉积为特征的致命性疾病,预后极差且缺乏有效根治手段。单细胞转录组揭示LEPR⁺肺泡成纤维细胞是病理性成纤维细胞的主要来源。在肺纤维化模型中,82% LEPR⁺细胞转化为 α-SMA⁺肌成纤维细胞和 CTHRC1⁺POSTN⁺病理性成纤维细胞,证实其为纤维化的核心效应细胞。scATAC-seq 分析表明,病理性成纤维细胞中 RUNX2 结合基序的染色质开放度为正常细胞的 3.2 倍,可直接结合 Col1a1、Postn 等纤维化基因的启动子并激活其表达;RUNX2 在纤维化区域的表达量为正常组织的 8 倍,是调控肺泡成纤维细胞向病理性表型转化的关键因子。Scube2-CreERT2 介导的肺泡成纤维细胞特异性敲除RUNX2,可使纤维化程度降低 45%,羟脯氨酸含量下降 40%,且不影响正常肺功能。
总之,通过scRNA-seq、scATAC-seq等技术,明确了LEPR⁺肺泡成纤维细胞是病理性成纤维细胞的主要来源,转录因子 RUNX2 是驱动肺泡成纤维细胞向病理性成纤维细胞转化的关键调控因子,证实靶向敲除 RUNX2 可显著减少细胞外基质沉积,为肺纤维化治疗提供了精准靶点。
研究三
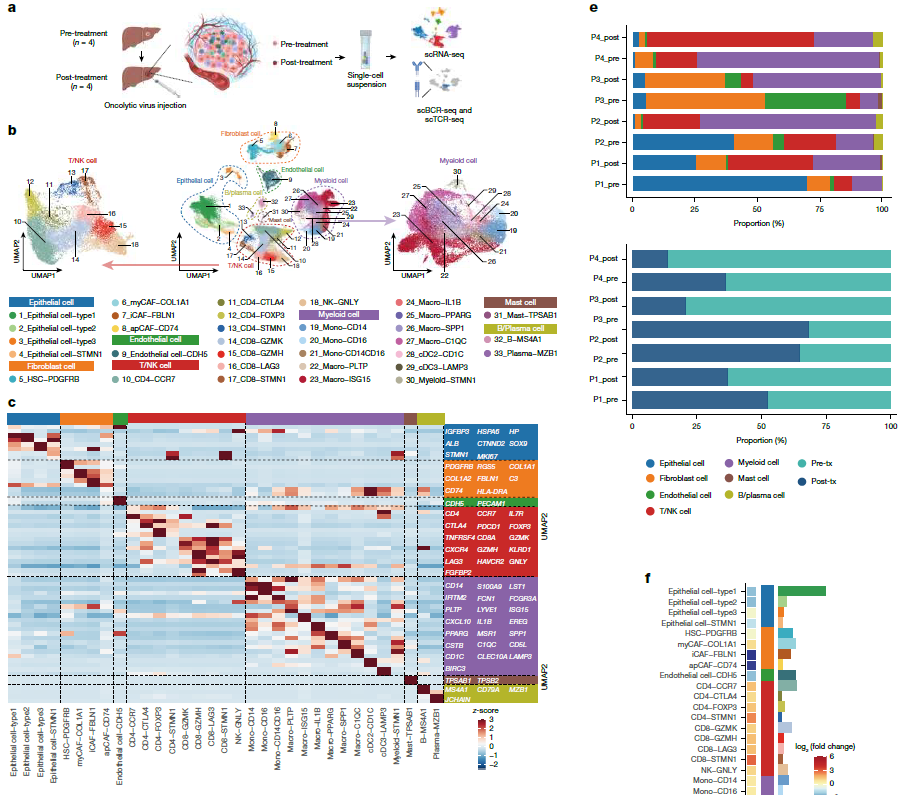
利用溶瘤病毒VG161治疗难治性肝细胞癌
文章标题:Oncolytic virus VG161 in refractory hepatocellular carcinoma
发表期刊:Nature(IF 48.5)
发表时间:2025年
组学技术:单细胞转录组、空间转录组
溶瘤病毒通过靶向癌细胞进行选择性复制和裂解,从而刺激抗癌免疫,提供了一种新的机制。这些病毒不仅破坏癌细胞,还会释放与癌症相关的新抗原,增强全身抗肿瘤免疫力。VG161是一种工程化的溶瘤单纯疱疹病毒,表达IL-12、IL-15、IL-15Rα和PD-1–PD-L1阻断融合蛋白。VG161耐受性良好,没有观察到剂量限制性毒性,并且它通过重塑肿瘤免疫微环境和重新敏化先前对全身治疗有抗性的肿瘤而显示出有希望的疗效。研究表明VG161在难治性HCC患者中展现出良好的安全性和初步疗效,为三线治疗提供了新选择。其作用机制涉及重塑肿瘤免疫微环境、激活系统性抗肿瘤免疫,并可能逆转既往治疗耐药。亚组分析提示,VG161联合检查点抑制剂或后续系统治疗 (PST) 可进一步延长生存。同时证实,常用抗乙肝药物 (如恩替卡韦) 不影响VG161的复制或疗效,这对乙肝高发的HCC患者至关重要。
总体而言,VG161为晚期HCC的免疫治疗开辟了新路径,其独特的溶瘤与免疫协同机制有望推动肝癌治疗领域的进一步发展。
文章四
人肝脏单细胞图谱揭示细胞异质性,发现新祖细胞亚群
文章标题:A human liver cell atlas reveals heterogeneity and epithelial progenitors
发表期刊:Nature(IF 48.5)
发表时间:2019年
技术手段:单细胞转录组
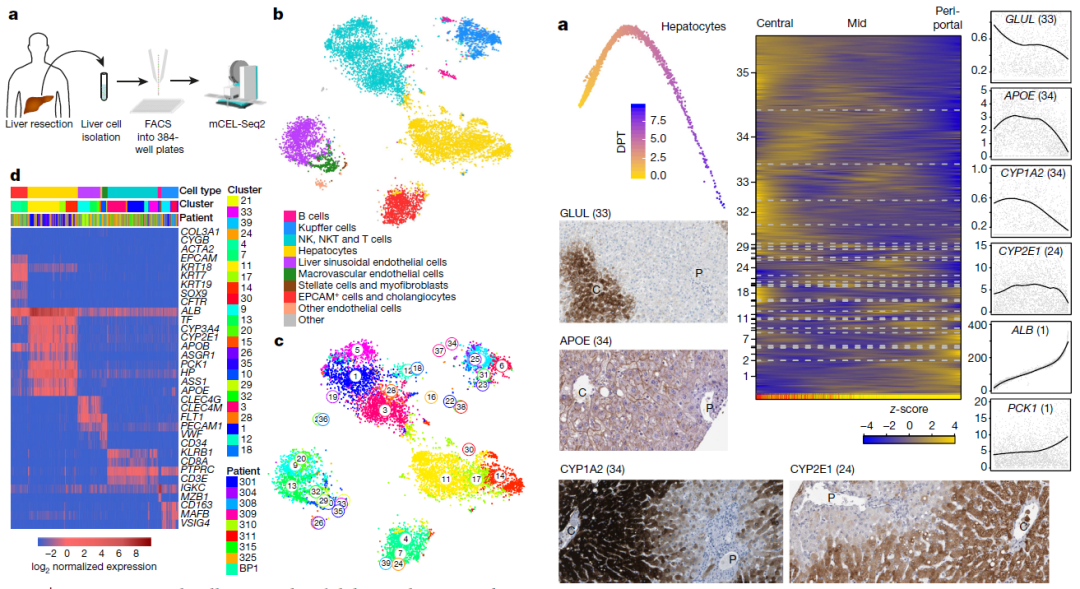
肝脏是一个关键的多功能器官,肝脏相关的疾病是广泛存在的公共健康问题,然而人类对肝脏内细胞的组成、分布和功能仍旧缺乏理解。利用单细胞测序技术,从九个人类肝组织中收集了10000个单细胞转录组数据,构建了一个肝脏内细胞的单细胞测序图谱,鉴定并标记了已知的肝脏内细胞类型。随后,利用单细胞图谱分析了EPCAM+细胞聚类中的细胞异质性,并从中鉴定出了一种未被识别过的具有双向分化能力的祖细胞。
利用该单细胞图谱分析了肝癌癌组织细胞以及从嵌合小鼠模型中纯化出的人类细胞,展现了它们相对于健康人类肝细胞之间差异性。
研究五
揭示了一个肿瘤免疫治疗响应及耐药新机制
文章标题:Contrasting cytotoxic and regulatory T cell responses underlying distinct clinical outcomes to anti-PD-1 plus lenvatinib therapy in cancer
发表期刊:Cancer Cell(IF 44.5)
发表时间:2025年
技术手段:Bulk 转录组、单细胞转录组、免疫组库
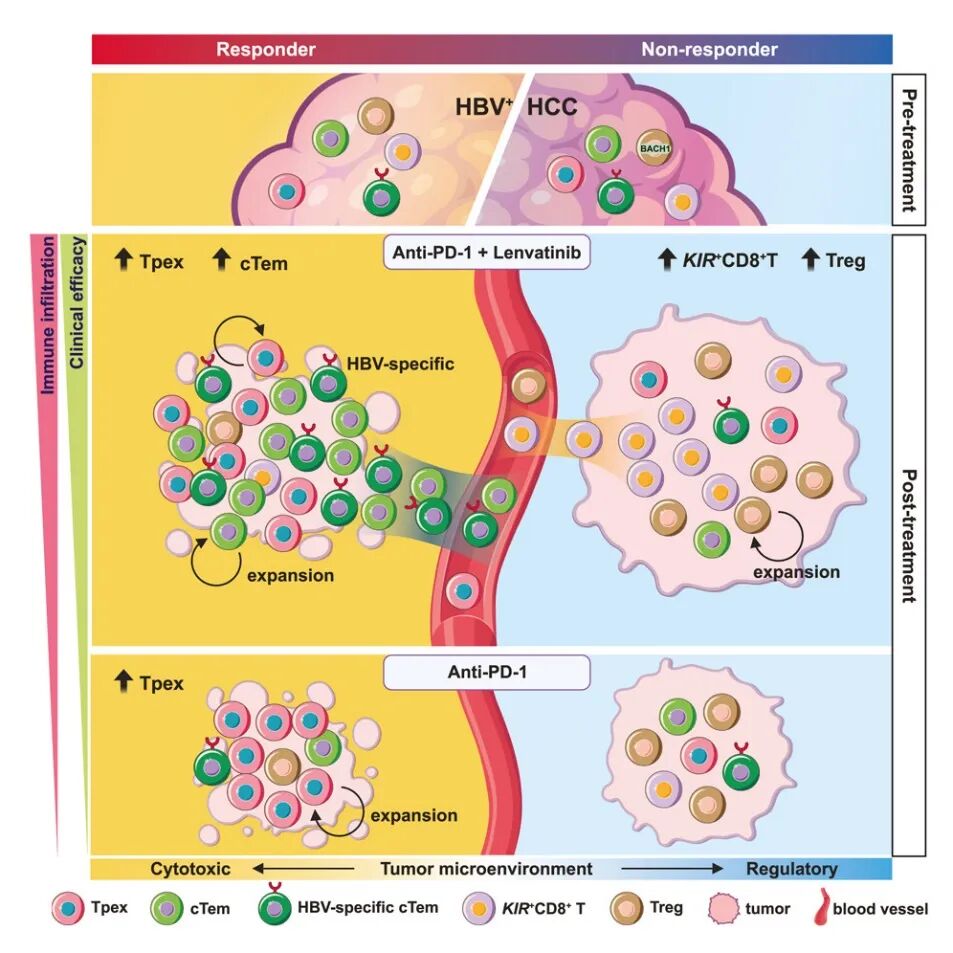
西湖大学/上海市免疫治疗创新研究院董晨院士、中国解放军总医院卢实春教授、深圳湾实验室张雷研究员等团队合作,揭示了在接受抗PD-1联合仑伐替尼治疗的癌症患者中与临床预后相关的T细胞应答及耐药机制。肿瘤浸润的GZMK+CD8+ Teff/Tem细胞对联合治疗呈现良好应答。进一步的整合分析表明,cTem细胞与联合治疗的应答特异性相关,而Tpex细胞则对联合治疗和抗PD-1单药治疗均有帮助。值得注意的是,KIR+CD8+ T细胞亚群和FOXP3+ CD4+调节性T细胞在联合治疗后的无应答者中特异性富集。这些发现加深了对免疫应答和耐药机制的理解,鉴定了一系列具有极大前景的潜在治疗性靶点和生物学标志物,为体外扩增肿瘤特异性T细胞贡献了新方法。
这些发现加深了对免疫应答和耐药机制的理解,鉴定了一系列具有极大前景的潜在治疗性靶点和生物学标志物,为体外扩增肿瘤特异性T细胞贡献了新方法。
文章六
细胞毒性 T 淋巴细胞的癌周交叉呈递会损害肝细胞癌的免疫治疗效果
文章标题:Pericancerous cross-presentation to cytotoxic T lymphocytes impairs immunotherapeutic efficacy in hepatocellular carcinoma
发表期刊:Cancer Cell(IF 44.5)
发表时间:2024年
技术手段:单细胞转录组、单细胞TCR测序、空间转录组
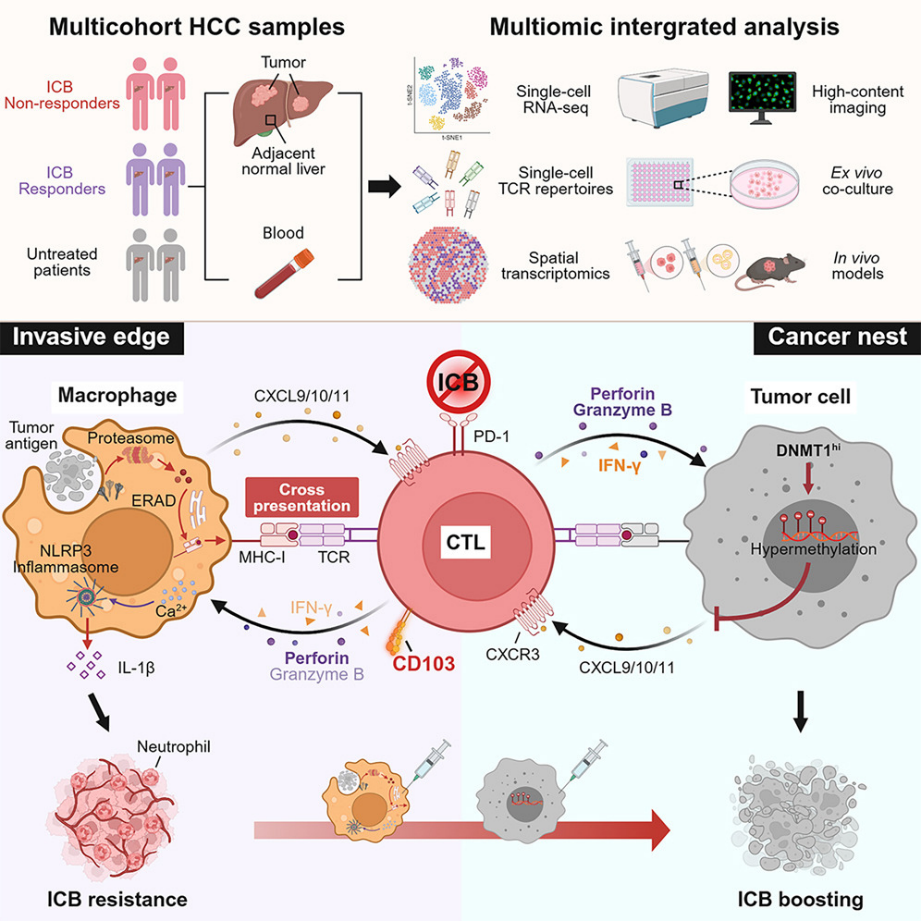
细胞毒性T淋巴细胞(CTL)是抗肿瘤免疫的关键效应细胞,它们的浸润通常是有效的免疫检查点阻断(ICB)治疗的预测性生物标志物。一小部分肿瘤内富集CTL的患者能从ICB疗法中获益,然而CTL在人类癌症中是否以及如何发挥促癌作用尚不明确。对肝细胞癌(HCC)患者的单细胞RNA测序(scRNA-seq)和空间转录组学分析表明,尽管存在组织驻留效应细胞表型,但CD103+CTL的聚集预示着接受多种治疗的HCC患者的不良临床结局。揭示了HCC中,癌周巨噬细胞通过内质网(ER)相关的降解机制介导的胞质途径途径将抗原交叉呈递给肿瘤反应性细胞毒性T淋巴细胞(CD103+CTL),这一过程导致CD103+CTL滞留在癌周区域,从而激活巨噬细胞中的NLRP3炎症小体,促进肝癌进展和免疫治疗抵抗。相应地,靶向肿瘤微环境中CD103+CTL重新分布的治疗策略,不仅能促进肿瘤内CD103+CTL的浸润,还能削弱癌周巨噬细胞的促肿瘤炎症反应,从而增强ICB疗法对HCC的治疗效果。
鉴于这些发现,研究团队认为,建议将抗PD-1/PD-L1等ICB疗法与重新分布CD103+CTL的药物联合,可能有助于HCC的治疗。
研究七
揭示非小细胞肺癌新辅助免疫治疗(PD-1)后的免疫微环境异质性
文章标题:A single-cell atlas reveals immune heterogeneity in anti-PD-1-treated non-small cell lung cancer
发表期刊:Cell(IF 42.5)
发表时间:2025年
技术手段:单细胞转录组、免疫组库
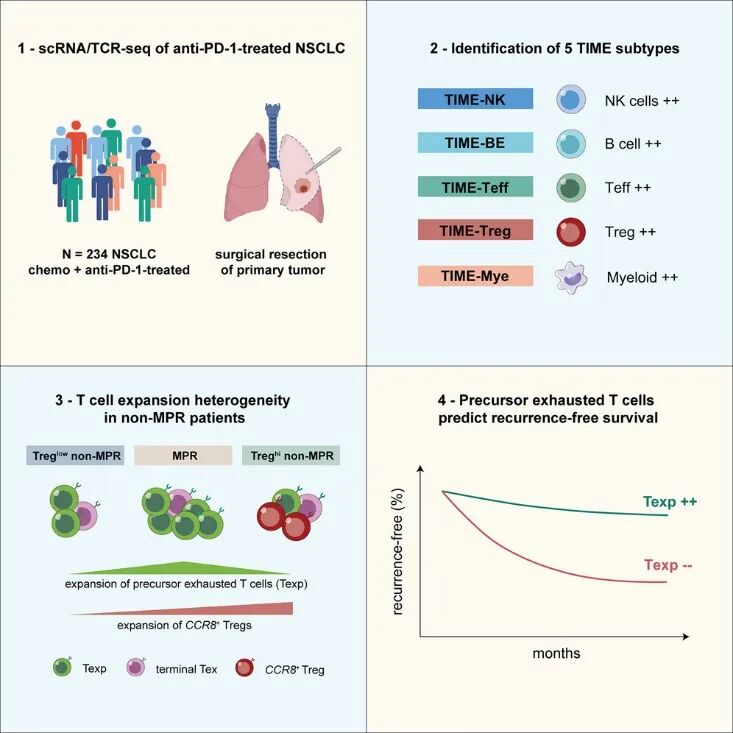
北京大学BIOPIC/重庆医科大学张泽民院士、中国医学科学院肿瘤医院高树庚教授、同济大学附属上海市肺科医院陈昶教授、广东省人民医院钟文昭教授、郑州大学第一附属医院张毅教授、昌平实验室/重庆医科大学程斯进研究员、北京大学BIOPIC朱琳楠副研究员、深圳市人民医院邹畅教授、同济大学附属上海市肺科医院佘云浪副研究员、中国科学技术大学田志刚院士等多团队联合。使用scRNA/TCR-seq分析了234例新辅助化学免疫治疗后非小细胞肺癌患者的外科肿瘤样本。揭示了具有不同主要病理反应(MPR)率的五种不同的时间亚型。MPR患者的FGFBP2+ NK/NK样T细胞、记忆B细胞或效应T细胞水平升高,而非MPR患者的CCR8+ Tregs水平较高。T细胞克隆扩增分析揭示了非MPR患者的异质性,以Tex相关细胞和CCR8+ Tregs的不同扩增为标志。前体衰竭T细胞(Texp细胞)与无复发生存期相关,确定了一个尽管缺乏MPR但复发风险降低的患者亚组。
本研究系统性的阐释了非小细胞肺癌患者在新辅助免疫治疗联合化疗后的免疫微环境异质性,识别了患者在耐药机制方面的潜在差异,并开发了预测患者复发风险的新型生物学标志物。
文章八
单细胞+空间组学破解胆管癌耐药之谜:肝外亚型特有祖细胞生态位驱动化疗抵抗
文章标题:Deciphering cholangiocarcinoma heterogeneity and specific progenitor cell niche of extrahepatic cholangiocarcinoma at single-cell resolution
发表期刊:J Hematol Oncol(IF 40.4)
发表时间:2025年
技术手段:单细胞转录组、空间转录组
胆管癌 (CCA) 代表着一种异质性恶性肿瘤谱,包括肝内胆管癌 (iCCA) 和肝外胆管癌 (eCCA)。临床中难以区分iCCA与eCCA主要是因为对它们共同及亚型特异性细胞异质性的理解不足。该研究绘制了一个涵盖28例初治患者(iBT、iCCA、eCCA-P、eCCA-D)的胆管癌单细胞图谱,详细描述了 CCA 的转录组多样性、异质性和表型亚型。通过NMF算法将癌细胞分为4种亚型:增殖型(G1/S和G2/M特征)、腺体型(粘膜防御和代谢特征)、干扰素应答型(腺性和IFN相关特征)和衰老型。IFN应答型多见于eCCA,与晚期分期、转移及不良预后相关;增殖型同样预后差,衰老型生存期较好。CCA类器官(PDOs)结合175种药物的药敏实验显示,IFN应答型耐药性显著,衰老型和腺体型更敏感。单细胞轨迹分析发现,LY6D⁺细胞具干性特征(CytoTRACE评分↑),是eCCA分化起点。eCCA 中存在 LY6D⁺ 基底样前体细胞,周围伴有 ISG15 高表达的周细胞、巨噬细胞和 CD8⁺ T 细胞形成特定微环境。首次明确了 eCCA 特有的 LY6D+ 基底样祖细胞亚群,该亚群聚集在富含 ISG15 的 TME 生态位中。TME 中的 ISG15 信号转导促进这些祖细胞的出现和生长,并导致耐药性。
因此,在肝外胆管癌中发现基底样祖细胞及其富含ISG15的微环境,可能为开发针对祖细胞生态位的预后生物标志物和精准肿瘤治疗方案开辟新途径。
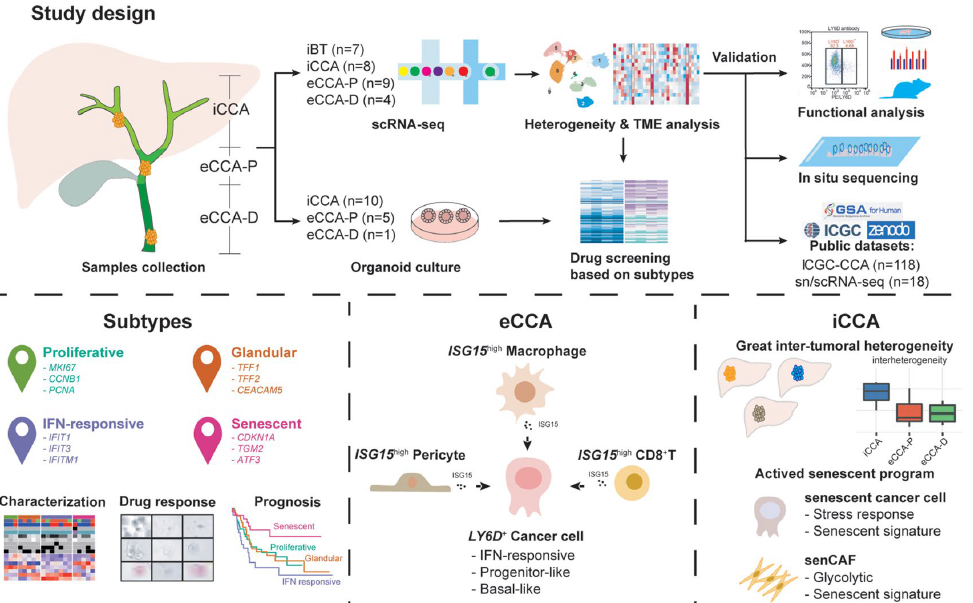
文章九
通过纳米颗粒介导的ACSL3沉默调控脂质代谢,抑制肝细胞癌的生长与转移
文章标题:Modulating lipid metabolism by nanoparticles (NPs)-mediated ACSL3 silencing to inhibit hepatocellular carcinoma growth and metastasis
发表期刊:Mol Cancer(IF 33.9)
发表时间:2025年
技术手段:蛋白组、单细胞转录组、转录组
肝脏作为脂质储存和代谢的中心器官,其功能失调与HCC密切相关。然而,其潜在机制复杂,尚未完全明确。通过对肝细胞癌患者的蛋白组和单细胞RNA测序(scRNA-seq)进行分析,发现ACSL3主要在肝细胞癌细胞中高表达,且与脂质代谢异常呈正相关,其高表达可预测肝细胞癌患者的不良预后。ACSL3通过增强HCC细胞的增殖、转移潜能及生存能力,直接驱动肝癌的生长与转移进程。ACSL3沉默后转录组分析显示,差异表达基因(DEGs)显著富集于PPAR及脂代谢相关通路,推测ACSL3通过激活PPARα通路驱动脂代谢重编程。在机制上,ACSL3能够促进POPC的合成,进而激活PPARα信号通路,并增强下游脂质代谢相关基因的转录,从而通过加速脂质分解代谢和合成代谢促进肝细胞癌的生长和转移。鉴于目前缺乏ACSL3的特异性抑制剂,研究者开发了一种内质网pH响应型纳米颗粒(NP)平台,用于系统性递送siACSL3,并证实其能够有效抑制肝细胞癌肿瘤生长和转移。
通过临床样本驱动的多组学整合(蛋白质组/scRNA-seq/TCGA/转录组),在单细胞分辨率下发现ACSL3可作为预测肝细胞癌患者预后的潜在标志物,而纳米颗粒介导的ACSL3沉默可能是肝细胞癌治疗的有效策略。
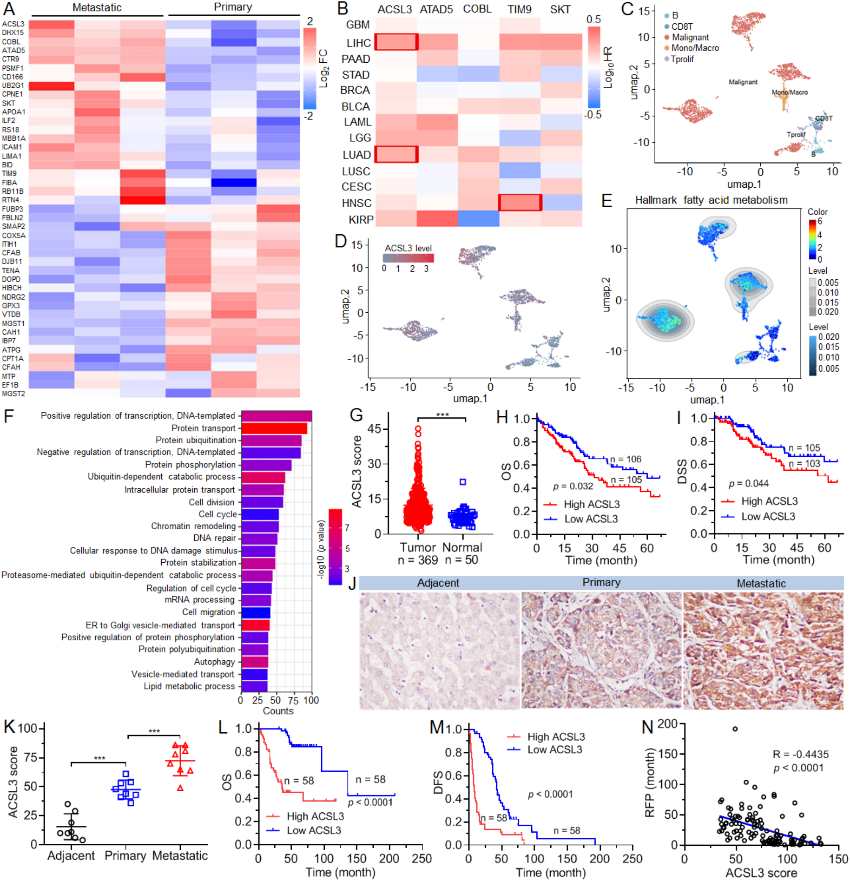
文章十
Tregs-CAFs通过TNFSF14-TNFRSF14信号通路介导SLD-HCC的免疫治疗耐药机制
文章标题:Targeting Treg–fibroblast interaction to enhance immunotherapy in steatotic liver disease-related hepatocellular carcinoma
发表期刊:Gut(IF 25.8)
发表时间:2025年
技术手段:单细胞转录组、CyTOF、Visium和CosMx空间转录组
在全球范围内,肝细胞癌(HCC)已成为第三大癌症死亡原因。其中,脂肪性肝病相关肝细胞癌(SLD-HCC)作为一种与代谢异常密切相关的亚型,因独特的肿瘤微环境(TME)特征,对现有免疫治疗的响应率显著偏低,成为临床亟待攻克的难题。通过单细胞RNA测序(scRNA-seq)分析肿瘤及癌旁组织的细胞异质性;采用CyTOF量化免疫细胞亚群;利用Visium和CosMx两种空间转录组平台,解析细胞的空间分布与互作。通过多组学技术深入解析了SLD-HCC的免疫微环境,揭示了Tregs与CAFs通过TNFSF14-TNFRSF14信号通路介导免疫抑制和治疗耐药的核心机制,为突破SLD-HCC的免疫治疗耐药难题提供了多维度启示。TNFSF14-TNFRSF14信号强度可作为预测SLD-HCC患者免疫治疗应答的潜在标志物,帮助筛选可能受益于联合治疗的人群。靶向TNFSF14-TNFRSF14通路可重塑TME,将“冷肿瘤”转化为“热肿瘤”,为免疫检查点抑制剂增敏。
首次揭示了Treg与CAFs的代谢适应及其空间互作在SLD-HCC中的核心作用,为理解代谢异常相关癌症的免疫逃逸机制提供了新视角。
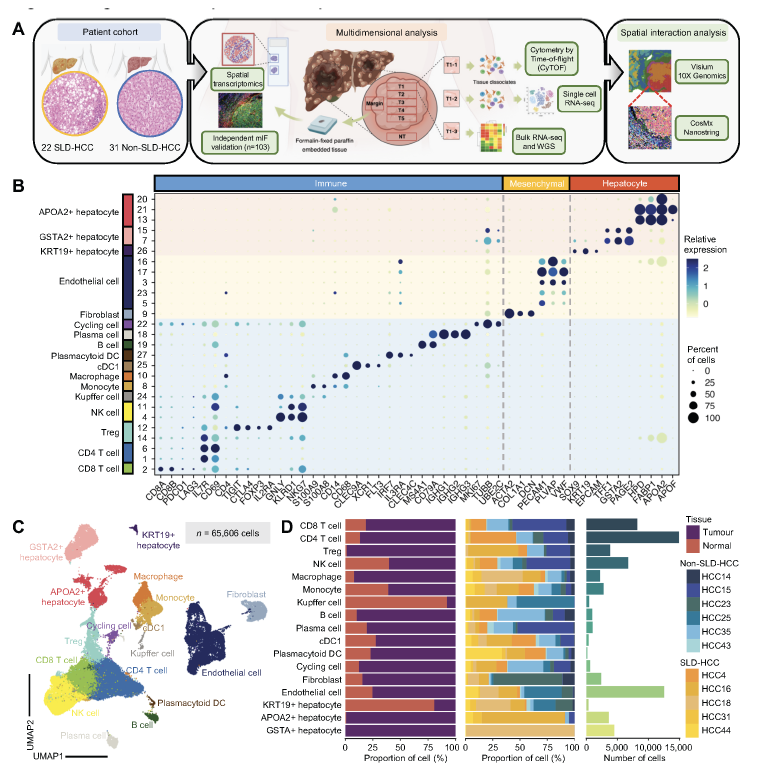
参考文献(上下滑动翻看)
[1] Li ZW, et al. Oit3, a promising hallmark gene for targetin liver sinusoidal endothelial cells. Signal Transduct Target Ther. 2023 Sep 12;8(1):344. doi: 10.1038/s41392-023-01621-2. PMID: 37696816.
[2] Fang Y, et al. RUNX2 promotes fibrosis via an alveolar-to-pathological fibroblast transition. Nature. 2025 Apr;640(8057):221-230. doi: 10.1038/s41586-024-08542-2. PMID: 39910313.
[3] Shen Y, et al. Oncolytic virus VG161 in refractory hepatocellular carcinoma. Nature. 2025 May;641(8062):503-511. doi: 10.1038/s41586-025-08717-5. PMID: 40108464.
[4] Aizarani N, et al. A human liver cell atlas reveals heterogeneity and epithelial progenitors. Nature. 2019 Aug;572(7768):199-204. doi: 10.1038/s41586-019-1373-2. PMID: 31292543.
[5] Guo X, et al. Contrasting cytotoxic and regulatory T cell responses underlying distinct clinical outcomes to anti-PD-1 plus lenvatinib therapy in cancer. Cancer Cell. 2025 Feb 10;43(2):248-268.e9. doi: 10.1016/j.ccell.2025.01.001. PMID: 39889705.
[6] Huang CX, et al. Pericancerous cross-presentation to cytotoxic T lymphocytes impairs immunotherapeutic efficacy in hepatocellular carcinoma. Cancer Cell. 2024 Dec 9;42(12):2082-2097.e10. doi: 10.1016/j.ccell.2024.10.012. PMID: 39547231.
[7] Liu Z, et al. A single-cell atlas reveals immune heterogeneity in anti-PD-1-treated non-small cell lung cancer. Cell. 2025 May 29;188(11):3081-3096.e19. doi: 10.1016/j.cell.2025.03.018. PMID: 40147443.
[8] Liu C, et al. Deciphering cholangiocarcinoma heterogeneity and specific progenitor cell niche of extrahepatic cholangiocarcinoma at single-cell resolution. J Hematol Oncol. 2025 Jun 23;18(1):66. doi: 10.1186/s13045-025-01716-z. PMID: 40551145.
[9] Huang L, et al. Modulating lipid metabolism by nanoparticles (NPs)-mediated ACSL3 silencing to inhibit hepatocellular carcinoma growth and metastasis. Mol Cancer. 2025 Mar 10;24(1):73. doi: 10.1186/s12943-025-02274-1. PMID: 40059153.
[10] Prawira A, et al. Targeting Treg-fibroblast interaction to enhance immunotherapy in steatotic liver disease-related hepatocellular carcinoma. Gut. 2025 Jul 30:gutjnl-2025-335084. doi: 10.1136/gutjnl-2025-335084. PMID: 40695620.
[11] Qiu X, et al. Spatial single-cell protein landscape reveals vimentinhigh macrophages as immune-suppressive in the microenvironment of hepatocellular carcinoma. Nat Cancer. 2024 Oct;5(10):1557-1578. doi: 10.1038/s43018-024-00824-y. PMID: 39327501.
[12] Cheng Y, et al. Stromal architecture and fibroblast subpopulations with opposing effects on outcomes in hepatocellular carcinoma. Cell Discov. 2025 Jan 28;11(1):1. doi: 10.1038/s41421-024-00747-z. PMID: 39870619.
和元多组学服务
和元生物提供多组学服务(如转录组、Astral蛋白组、代谢组、微生物组、Cut&Tag、MeRIP (m6A)-seq、WGBS、RRBS等)和单细胞及空间转录组服务(如10x单细胞转录组、10x单细胞转录组及TCR/BCR、墨卓单细胞转录组、DNBelab C-TaiM4单细胞转录组、CytAssist空间转录组、HD空间转录组、Stereo-seq 空间转录组等),致力于为广大生命科学家、医学工作者提供基于多组学的科研及临床应用解决方案。累计协助客户在Advanced Science、Journal of Nanobiotechnology、Advanced Functional Materials、ACS Nano、Nature Aging、Neuron等期刊发表SCI论文,并推出了广受好评的生信分析云平台,助您高效实现个性化数据挖掘!







