和元生物技术(上海)股份有限公司品牌商
13 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
公司新闻/正文
一文读懂神经元的三种 "对话信号":sEPSC、mEPSC 与 evoked EPSC
958 人阅读发布时间:2025-08-27 16:51
大脑功能的基础是神经元之间的信息传递,而兴奋性突触后电流(Excitatory Postsynaptic Current, EPSC)是这一过程的关键电信号。这些微弱的电流信号,是神经元之间“对话”的物理载体。根据记录方式和生理意义的不同,常见的EPSC数据可分为三类:自发兴奋性突触后电流(sEPSC)、微小兴奋性突触后电流(mEPSC)和诱发兴奋性突触后电流(evoked EPSC)。它们在产生机制、所反映的生理过程及研究应用中各有侧重,理解它们的异同,是精准解读神经元通讯语言的关键。本文中,我们将对这三类EPSC进行系统梳理与比较。
一、概念界定:不同名称,不同内涵
sEPSC (Spontaneous EPSC, 自发兴奋性突触后电流)是指在没有任何外部实验性刺激(如电刺激神经纤维)的情况下,在突触后神经元上记录到的离散的兴奋性电流事件。它源于整个神经环路中突触前神经元的自发活动。这些活动可能是神经元自身节律性放电,也可能是受网络中其他神经元影响而产生的随机动作电位。当这些动作电位传导至突触末梢,便触发神经递质囊泡(囊泡包含了神经递质,对于兴奋性电位来说主要是谷氨酸)的释放。作用于突触后膜的受体从而产生sEPSC。因此,sEPSC反映了在静息或基础状态下,神经元接收到的、依赖于动作电位的自发兴奋性输入的总和。其发生的频率和幅度受到多种因素的综合影响,包括整个网络的兴奋性水平、突触前神经元产生动作电位的概率、突触前囊泡的释放概率、突触的数量以及突触后受体的功能状态等。
mEPSC (Miniature EPSC, 微小兴奋性突触后电流)则是在人为阻断动作电位传导(实验中通常使用TTX)的条件下,记录到的自发兴奋性突触后电流事件。TTX特异性地阻断了电压门控钠通道,从而完全消除了动作电位的产生和传导。此时所记录到的mEPSC排除了动作电位的驱动,完全由突触前终末内单个神经递质囊泡的自发性、量子化释放引起。mEPSC代表了突触传递的最小功能单位——单个囊泡释放所引起的突触后效应。它的发生频率由突触前囊泡的自发释放概率决定。而其幅度主要反映突触后膜上受体(主要是AMPA受体)的密度、单通道电导特性等突触后功能。因此,mEPSC是研究纯粹的突触后特性以及突触前自发释放机制的“金标准”。
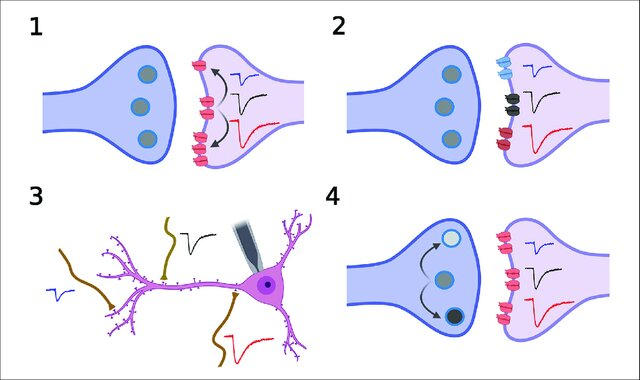
图 影响突触后电位的几种因素
影响突触后电流的潜在因素包括
1)突触后受体的数量;
2)突触后受体的类型或组成比例(比较典型的就是兴奋性突触后的AMPA/NMDA受体比例);
3)突触前、后膜的相对位置关系,越靠近胞体的,电流越大;
4)突触前囊泡递质的释放。
evoked EPSC (诱发兴奋性突触后电流)与前两者有本质的不同。它是通过实验手段(最常用的是精确定位的电刺激,有时也用光遗传学刺激)有目的地、选择性地激活特定的传入神经纤维束或通路,从而在目标突触后神经元上记录到的兴奋性突触后电流。外部刺激诱发被激活纤维产生动作电位,这些动作电位传导至其突触末梢,引发钙离子内流,触发大量囊泡同步释放神经递质,最终在突触后神经元产生一个较大且时间锁定的电流反应。evoked EPSC直接反映了在受控条件下,特定神经通路激活时的突触传递效能。其幅度受到多重因素的调节:刺激强度(激活的纤维数量)、突触前囊泡的释放概率(受钙动力学、突触前自身受体等调节)、递质释放位点的数量、突触后受体的密度和功能状态,以及该通路当前的突触可塑性状态(如长时程增强LTP或长时程抑制LTD)等。它是研究神经通路特异性功能、突触可塑性机制和信息整合的核心指标。
二、机制辨析与应用解读
解读膜片钳记录到的这三种EPSC信号,需要深刻理解它们各自的产生机制,因为它们揭示了神经元通讯中的不同层面。
sEPSC:神经网络自发活动的窗口
频率变化:
sEPSC频率的显著升高(如在某些癫痫模型或兴奋性毒性的研究中),通常强烈提示整个输入网络的兴奋性普遍增强,这可能源于突触前神经元活动增加、突触前释放概率提高、或者该神经元上功能性兴奋性突触的数量增多。相反,频率降低则可能反映网络抑制增强、突触丢失或突触前功能抑制。
幅度变化:
sEPSC幅度的变化解读相对复杂。幅度增大可能意味着单个事件涉及的突触前释放囊泡数量增多(如多个囊泡同步释放的概率增加),或者突触后受体功能增强(如AMPA受体插入增多)。幅度减小则可能对应突触前释放囊泡减少或突触后受体功能减弱。区分这两种可能性通常需要借助mEPSC的分析。
mEPSC:突触功能的探针
频率变化:
mEPSC频率的变化反映突触前终末单个囊泡的自发释放概率的改变(因为动作电位已被TTX阻断)。频率升高可能意味着突触前终末内钙库释放增加、囊泡融合机器敏感性提高或其他调节自发释放的分子机制被激活。频率降低则表明自发释放过程受到抑制。
幅度变化:
mEPSC的幅度几乎完全反映突触后特性。mEPSCs幅度增加明确提示突触后膜上功能性受体(以AMPA受体为主)的密度增加、单通道电导增大或受体对递质的亲和力增强。反之幅度减小则指向突触后受体功能的下调(如受体内吞,在LTD中常见)或受体特性的改变。
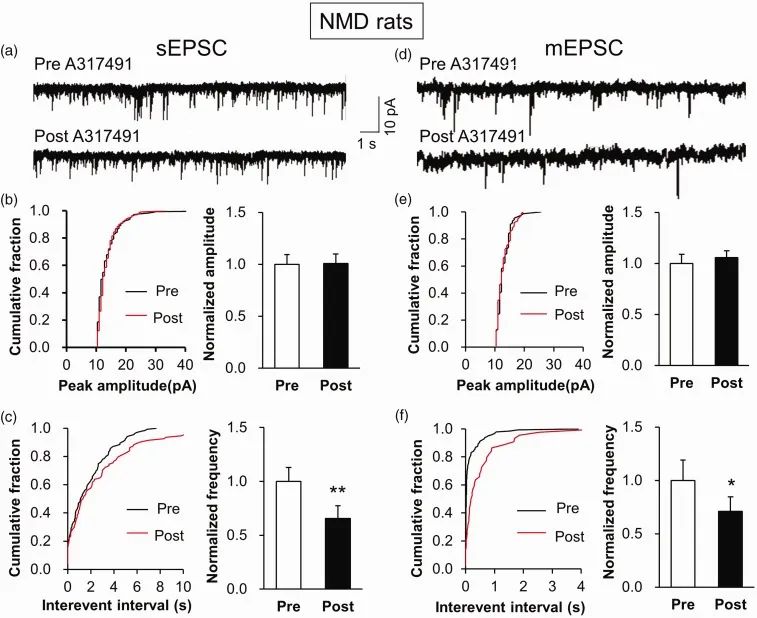
图 实战中的sEPSCs和mEPSCs
为了探索药物对NMD(新生儿母婴分离)大鼠突触传递的影响,研究者分别记录了岛叶皮层的sEPSCs和mEPSCs。通过分析突触后电流的频率和振幅的改变,研究者发现A317491药物孵育后,岛叶皮层的突触后电流频率显著下调,提示药物作可能用于突触末梢调节了突触前膜囊泡的释放。
evoked EPSC:通路特异性与突触可塑性
幅度变化:
evoked EPSC幅度的持久性改变(如LTP/LTD)是研究突触可塑性的核心指标。这种变化可能是突触前机制(如囊泡释放概率增加/减少)、突触后机制(如受体响应增强/减弱),或者两者共同作用的结果。要区分机制,常需结合mEPSC分析(看突触后是否有变)并同时分析突触可塑性诱导过程中突触反应变异系数(CV)的变化(CV减小提示突触前释放概率增加)。
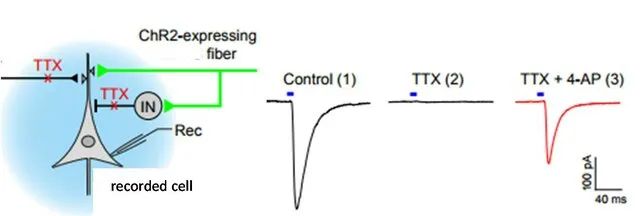
图 使用evoked EPSCs验证单突触连接
这是一个evoked EPSCs最典型的应用:用于判断两个脑区之间的连接是否是单突触。首先需要做的准备工作是在上游脑区注射表达ChR2光敏元件的AAV病毒从而使得突触末梢可以受光刺激产生动作电位。电压钳下记录光刺激诱发的突触后电流,可以确认上下游脑区之间存在连接。然后在浴液中加入TTX阻断动作电位,突触后电流自然消失。然后是整个实验最关键的一步,在电极外液中加入电压门控钾离子通道拮抗剂4-AP。4-AP的加入可以阻止突触前膜的复极化从而挽救单突触连接引发的突触后电位。而通过中间神经元的间接连接则因TTX的存在依旧被抑制。为了进一步验证突触连接的递质,还可以在最后加入不同受体的抑制剂来达到这个目的。
短时程可塑性:
通过给予两个紧密间隔的刺激并观察第二个evoked EPSC相对于第一个的变化(易化或抑制),可以直接探究突触前短时程可塑性机制(如残留在突触前末梢的钙离子浓度对后续释放的调节作用)。PPF(配对脉冲易化)通常提示低初始释放概率,而PPD(配对脉冲抑制)则可能与递质耗竭或突触前自身受体激活有关。
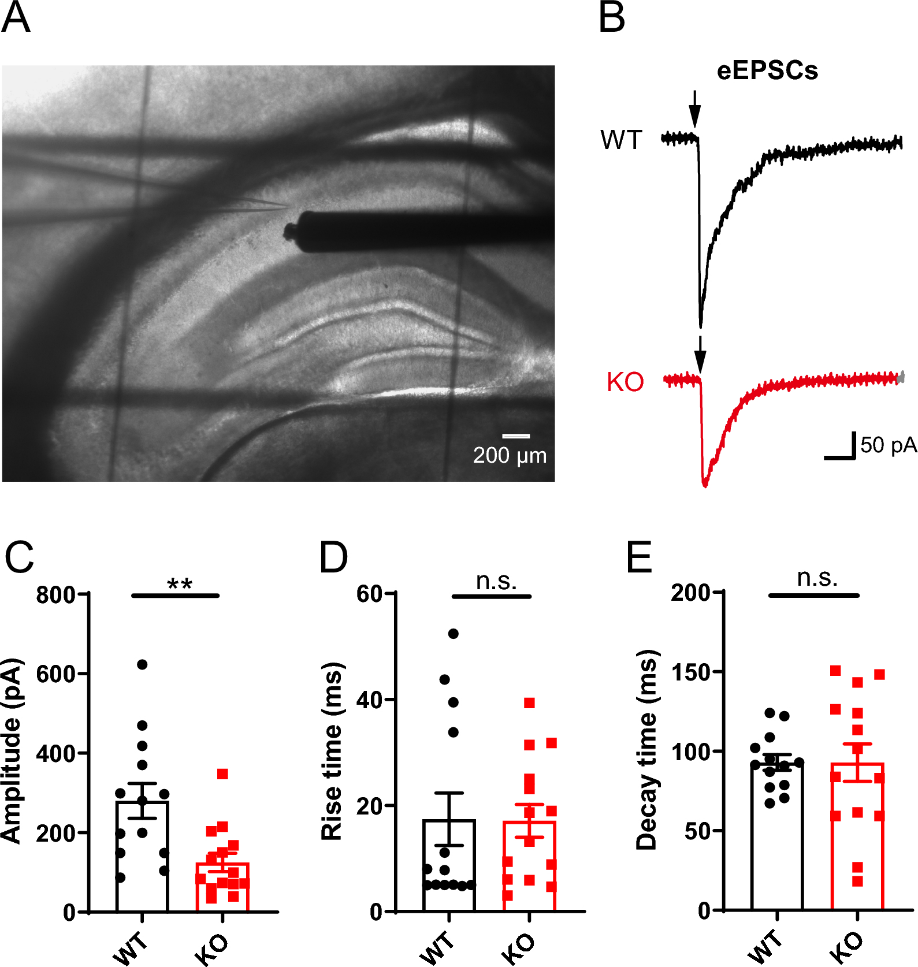
图 evoked EPSCs记录揭示谷氨酸突触连接的损伤
为了检测Opcml−/−敲除鼠海马区谷氨酸突触连接的变化,刺激电极被放置在了海马的Schaffer 侧枝,同时记录电极记录CA1区锥体神经元的突触后电流。电刺激诱发的突触后电流在转基因鼠细胞中显著下降,而其他突触传递相关的参数如上升和衰退时间则无明显变化,这提示突触后的兴奋性反应在转基因鼠中遭到了破坏。
总 结
sEPSC、mEPSC和evoked EPSC分别从不同层面揭示了突触传递的特性。它们各自具有独特的产生机制和研究应用价值。综合分析这三类信号,是全面理解神经元通讯和突触功能的关键。
和元生物提供高效、优质的膜片钳电生理记录服务,可以满足不同类型EPSCs记录需求,欢迎联系销售工程师咨询。







