和元生物技术(上海)股份有限公司品牌商
13 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
公司新闻/正文
Molecular Cancer | 香港中文大学研究团队解析幽门螺杆菌通过CAFs介导胃癌免疫抑制的双轴机制
12 人阅读发布时间:2025-12-10 13:57
肿瘤相关成纤维细胞(CAFs)是肿瘤微环境的关键调节因子,但其在幽门螺杆菌相关胃癌 (GC) 中的空间组织和免疫调节功能仍未完全了解。
2025年11月6日,香港中文大学研究团队在Molecular Cancer(IF=33.9)发表题为Spatial and functional dissection of cancer-associated fibroblasts-mediated immune modulation in H. pylori-associated gastric cancer的研究成果。
整合空间转录组学与单细胞RNA测序技术,系统解析了幽门螺杆菌(H. pylori)感染对胃癌肿瘤微环境中癌症相关成纤维细胞(CAFs)的空间分布、功能状态及其免疫调控作用的影响。
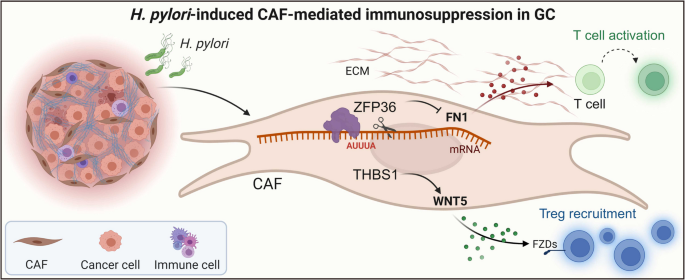
研究明确了CAFs的四种功能亚型,并发现H. pylori感染可显著上调CAFs中THBS1与ZFP36的表达。机制上,THBS1+ CAFs通过WNT5–FZD信号轴促进调节性T细胞(Treg)的招募与局部免疫抑制;而ZFP36则通过结合FN1基因的3′UTR并促进其mRNA降解,抑制CAFs介导的细胞毒性T细胞活化。这两条通路共同塑造了H. pylori阳性胃癌的“免疫冷”微环境,为靶向CAFs的免疫治疗策略提供了新的分子依据。
·研究结果·
1. GC肿瘤微环境表现出不同的空间结构、细胞组成和免疫环境
为了构建胃癌肿瘤微环境(GC TME)的空间分辨图谱,整合了人胃癌组织的单细胞RNA测序(scRNA-seq)和空间转录组数据。全面分析了TME内的细胞异质性、空间定位、细胞间通讯和谱系动态,涉及的分析包括:邻域富集分析、配体-受体推断、拟时序分析、空间反卷积和功能注释(图 1A)。
研究发现,幽门螺杆菌感染通过转录重编程癌相关成纤维细胞(CAFs)重塑了胃癌的肿瘤免疫微环境。THBS1⁺ CAF亚群聚集在调节性T细胞(Tregs)附近,可能通过WNT5-FZDs信号通路募集Tregs。同时,RNA结合蛋白ZFP36结合于FN1 3′UTR中富含AU(AUUUA)的元件,促进FN1 mRNA降解,并抑制细胞毒性T淋巴细胞(CTL)的活化。因此,维持 Treg 的 THBS1-WNT5 轴和限制 CTL 活化的 ZFP36-FN1 轴可能共同作用以驱动幽门螺杆菌阳性胃癌中的局部免疫抑制(图 1B)。
图1幽门螺杆菌相关胃癌中 CAF 介导的局部免疫抑制
对空间转录组数据进行细胞类型注释,鉴定出免疫细胞、基质细胞和恶性细胞群,如T细胞、B细胞、树突状细胞、髓系细胞、内皮细胞、成纤维细胞、平滑肌细胞和恶性上皮细胞(图 2 A-B)。根据Lauren分类,不同胃癌亚型在细胞组成和空间分布上存在明显的差异。在肠型胃癌中,癌细胞形成致密的上皮细胞簇,而癌相关成纤维细胞(CAFs)和免疫细胞则富集于肿瘤边缘,从而形成清晰的肿瘤-基质边界。相比之下,弥漫型胃癌中癌细胞、CAFs和免疫浸润细胞呈混合分布,导致肿瘤结构紊乱。与弥漫型胃癌相比,肠型胃癌中免疫细胞的比例更高(图 2 C-D)。综上所述,不同亚型的胃癌在空间组织上存在显著差异。
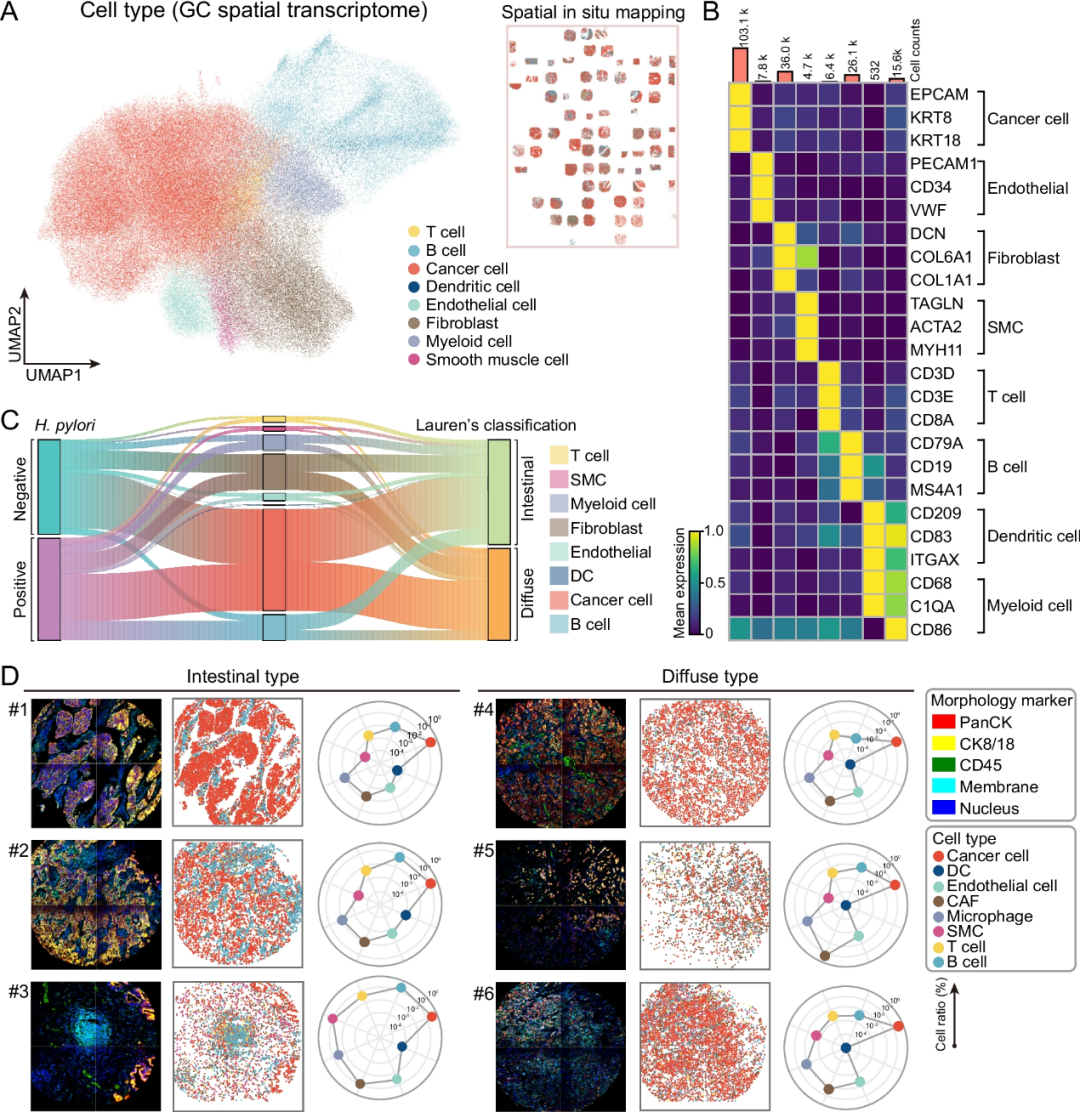
图2 空间转录组揭示了胃癌的细胞组成和亚型特异性
2. CAFs包含四种功能亚型,具有不同的空间分布偏好
为了研究CAFs的空间异质性,对四种CAF亚型,如proCAFs、iCAFs、matCAFs和myCAFs,进行了空间定位(图 3 A-B)。每种亚型均呈现出独特的分布,反映了肿瘤微环境内的功能区隔化。邻域富集分析进一步揭示了亚型与癌细胞的特异性空间关联。其中,iCAFs与癌细胞的距离最近(图 3 C)。空间聚集指数(SAI)也证实了这一趋势,iCAFs与癌细胞的空间邻近性最强,其次是myCAFs和matCAFs,而proCAFs的空间关联性最弱(图 3 D-E)。
空间原位映射揭示了亚型特异性的聚集模式:肠型肿瘤形成致密的上皮细胞簇,而弥漫型肿瘤则呈现分散分布。这些模式与不同的基质结构和CAF-肿瘤空间关联相对应(图 3F)。标记基因分析进一步证实了肠型和弥漫型胃癌之间的分子差异(图 3G)。与此一致的是,SAI评分表明肠型肿瘤的肿瘤细胞聚集程度显著高于弥漫型肿瘤(图 3H)。综上所述,这些分析表明肠型和弥漫型胃癌存在显著差异,支持亚型特异性的CAF-肿瘤相互作用。
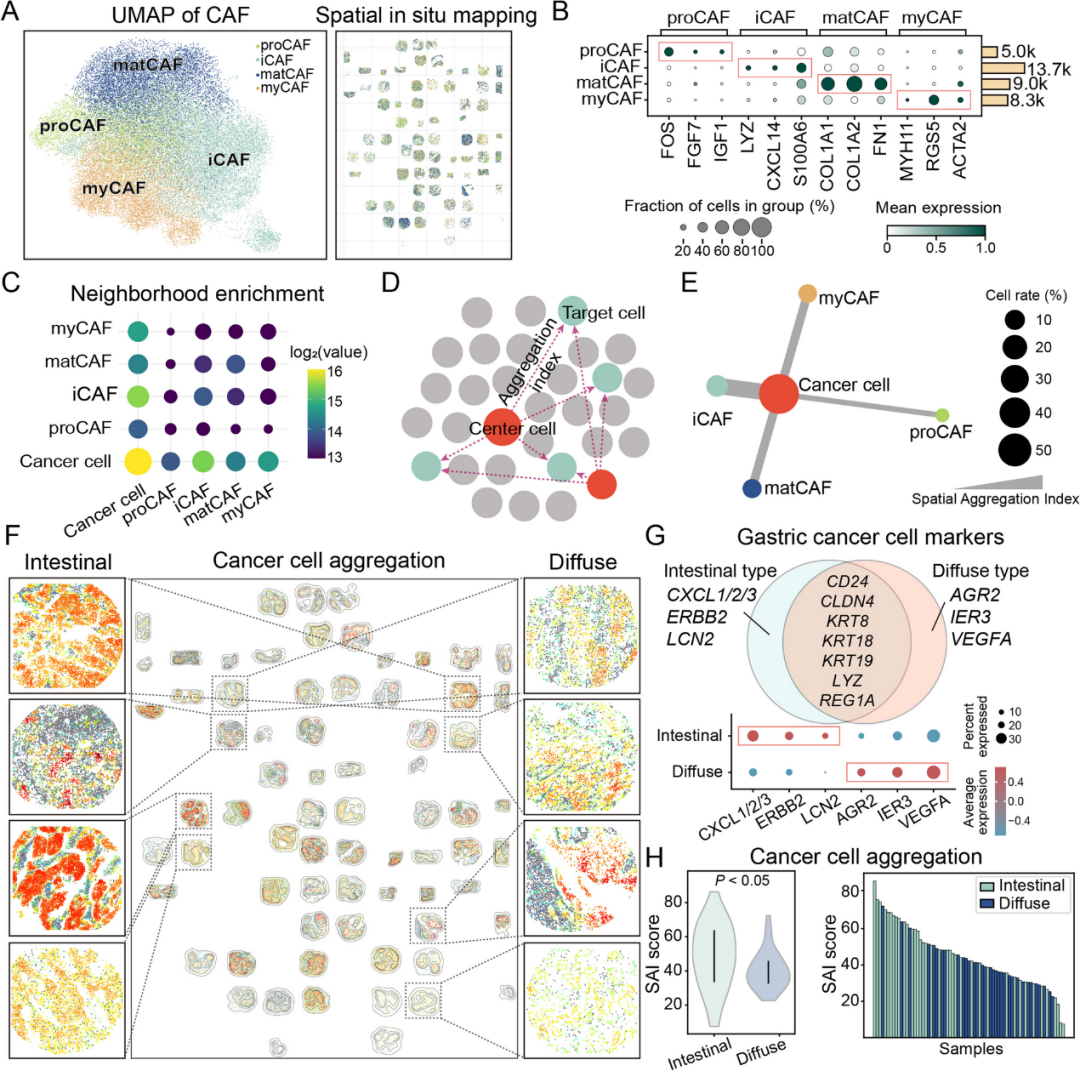
图3 CAF 亚型的空间特征及其与癌细胞的空间关联
3. 单细胞转录组学揭示 CAF 亚型的发育轨迹和转录特征
为了更深入地探索空间相关的基因表达,整合了来自中国、美国和新加坡的58个胃癌样本的单细胞RNA测序数据集。使用经典标记基因进行细胞类型注释,鉴定到了癌细胞、T细胞、B细胞、树突状细胞、髓系细胞、内皮细胞、成纤维细胞和平滑肌细胞(图 4 A-B)。其中,成纤维细胞可以细分为四种CAF亚型:proCAFs、iCAFs、matCAFs和myCAFs(图 4 C-E)。拟时序轨迹分析表明,proCAFs处于早期发育阶段,随之分化为三个不同的分支,分别是iCAFs、matCAFs和myCAFs(图 4F)。基因差异分析进一步强调了CAF亚型之间的转录组差异,揭示了它们的分子独特性和功能异质性(图 4G)。
此外,推断的空间分布与直接空间聚类得到的结果高度吻合(图4 H-I)。在对CAF亚型募集到癌细胞的单细胞反卷积分析中,iCAFs与癌细胞的空间聚集性最强,而proCAFs的关联性最弱,即iCAFs位于癌细胞附近(图 4 J)。这些发现表明,CAF亚型不仅在空间定位上存在差异,而且在发育状态和转录调控方面也存在差异,突显了TME内转录和空间异质性的协同作用。
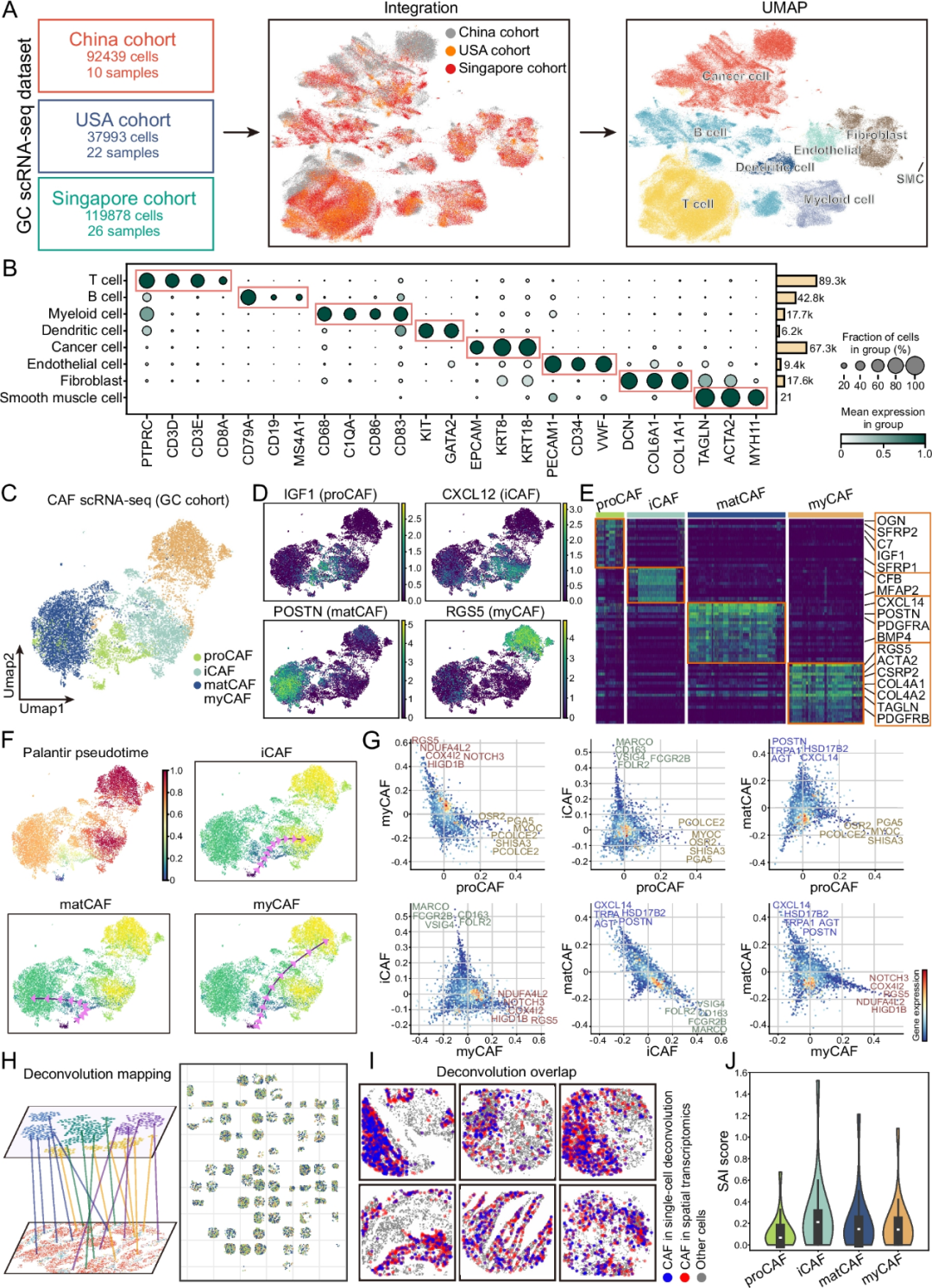
图4 单细胞转录组分析揭示CAF 亚型及其空间动态
4. 幽门螺杆菌感染可重塑胃癌CAF组成,并诱导THBS1和ZFP36表达
一个核心问题是幽门螺杆菌感染是否会改变胃癌表达谱,这些改变是如何影响CAF细胞组成及基因调控。为了解决这些问题,分析了幽门螺杆菌阳性和阴性胃癌的空间转录组数据。空间映射显示,感染肿瘤中CAF的丰度显著增加(图 5A )。此外,THBS1和ZFP36是幽门螺杆菌阳性样本中最显著上调的基因(图 5B -E)。在ACRG队列中也验证了这些发现(图 5 F)。
拟时序分析表明,THBS1 和 ZFP36在成纤维细胞终末阶段逐渐升高,同时凋亡相关基因 FAS 和 PTK2 也被诱导表达(图 5G)。在 TCGA 和 ACRG 数据集中,THBS1 和 ZFP36存在显著的正相关性(图 5H)。THBS1或 ZFP36高表达均预示着更短的生存期(图 5I)。综上所述,这些结果表明,幽门螺杆菌感染驱动 CAF 扩增,并诱导 THBS1 和 ZFP36 的转录激活。
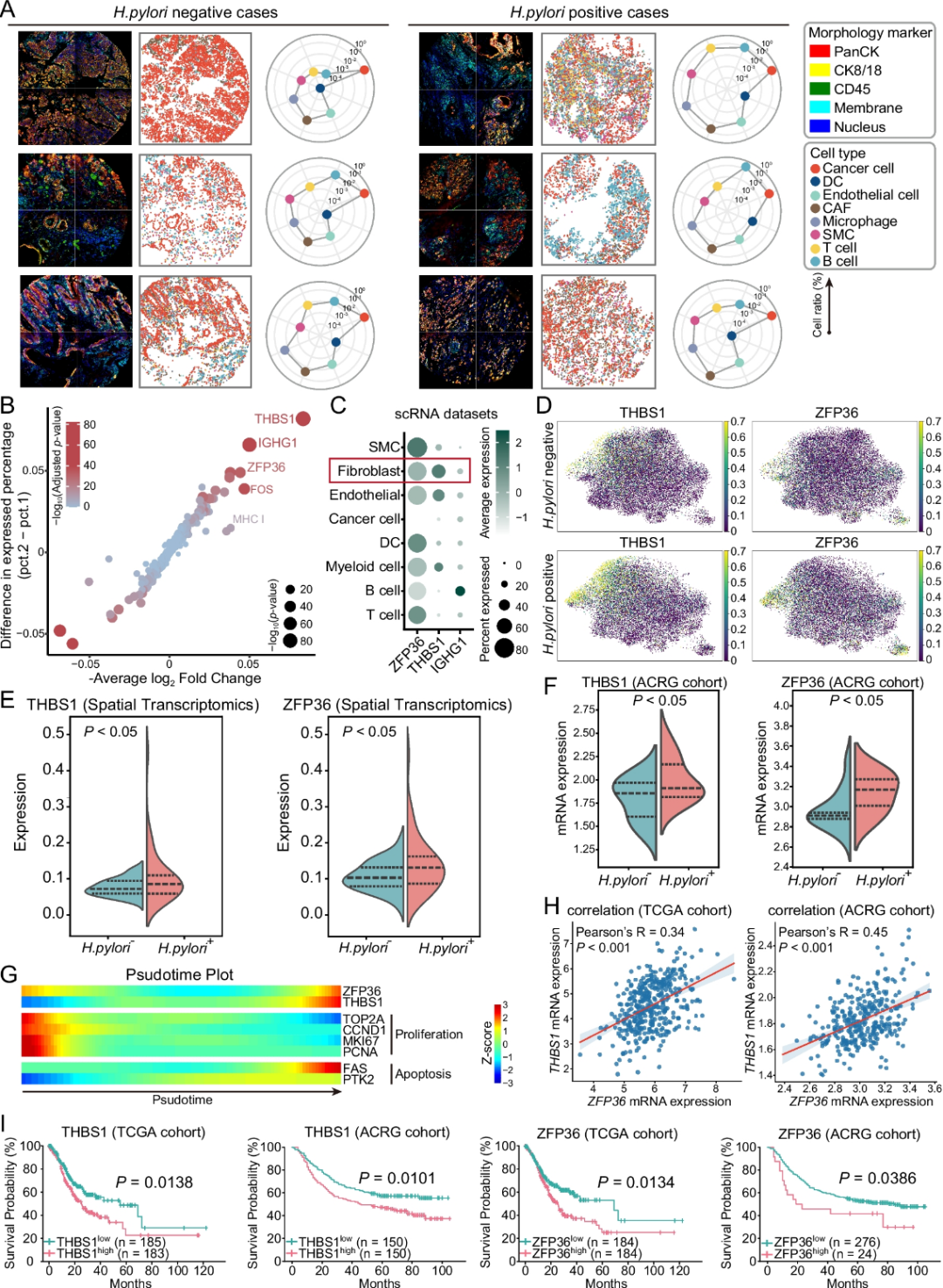
图5 THBS1 和 ZFP36 在幽门螺杆菌相关胃癌中的表达及其预后意义
5. THBS1+CAFs 通过 WNT5-FZDs促进 Treg 募集和免疫抑制
为了研究THBS1⁺CAFs在幽门螺杆菌阳性胃癌中的潜在免疫调节作用,根据THBS1表达分为THBS1⁺和THBS1⁻CAFs的细胞簇(图 6 A-B)。值得注意的是,THBS1⁺CAFs富集了调节性T细胞(Treg)相关的信号通路,包括FOXP3/TGF-β信号通路和CD4⁺ T细胞活化通路(图 6 C)。接下来,对T细胞群进行了表征,鉴定出六个亚群,如细胞毒性T淋巴细胞(CTL)、Treg、Th1、Th2、Th17和增殖性T细胞(图 6 D-E)。SAI分析揭示了Treg细胞与THBS1⁺CAFs之间存在显著的空间关联(图 6F)。THBS1⁺CAFs附近Treg细胞富集程度高的肿瘤与患者总生存期缩短相关(图 6G)。
此外,公共数据集(GSE25087和GSE7460)分析表明:Treg基因的空间分布与THBS1⁺ CAF的定位部分重叠(图 6I)。细胞间通讯分析表明,THBS1⁺ CAFs与Treg细胞之间存在相互作用,其中WNT5A-FZD6和WNT5B-FZD5是最显著的作用轴(图 6J-L)。这些结果表明,THBS1⁺ CAFs 在空间上与 Tregs 相关,并参与 WNT5-FZDs 信号传导,从而有助于在幽门螺杆菌相关胃癌中建立局部免疫抑制。
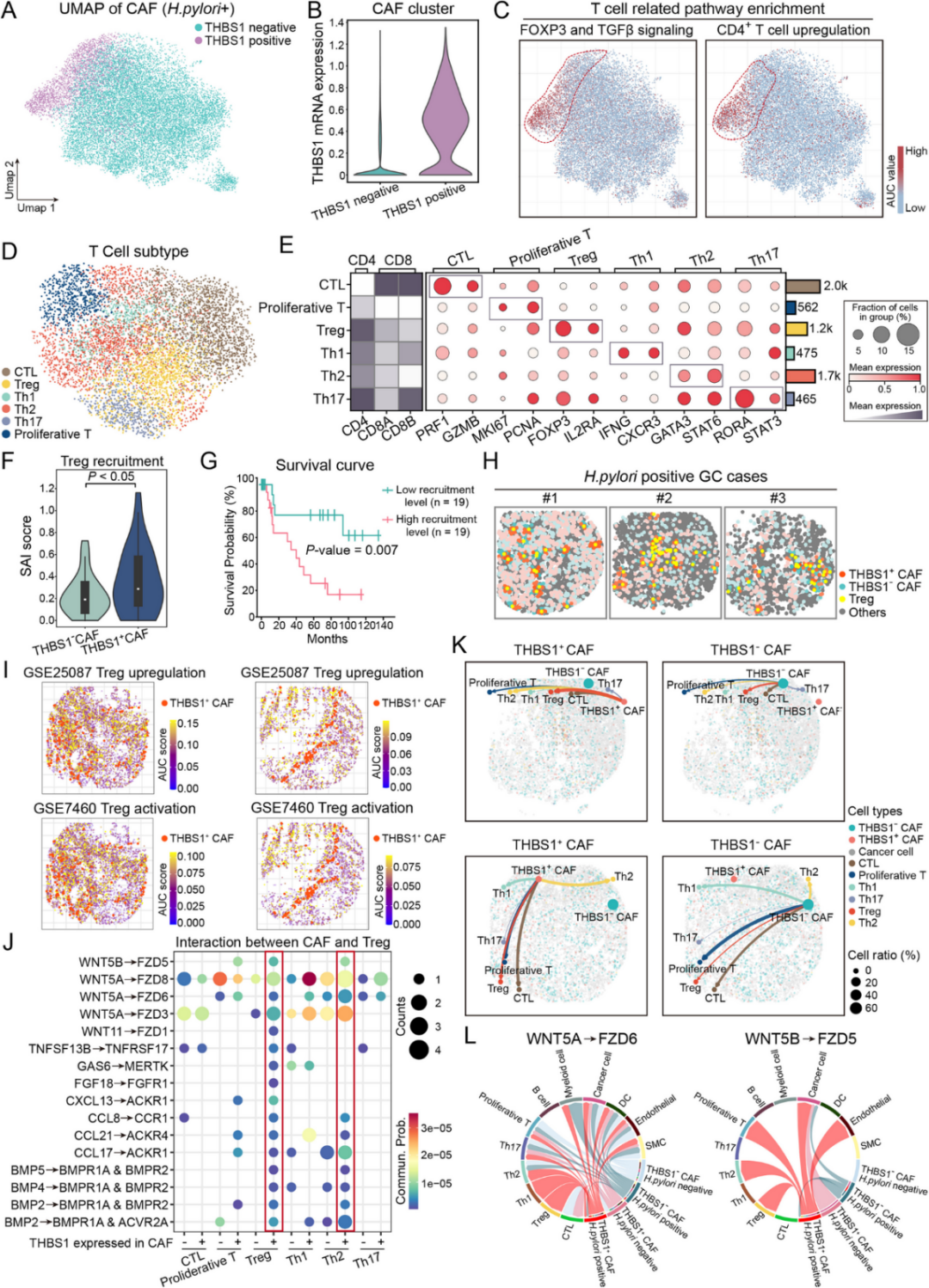
图6 THBS1+CAFs促进幽门螺杆菌相关胃癌中的Treg募集和免疫抑制
6. ZFP36通过转录后抑制作用抑制FN1 + CAF介导的细胞毒性T细胞活化
除了Treg 募集相关的通路外,研究了其他 CAF 亚群是否参与不同的免疫调节分子机理。为此检测了 CAF 相关转录本的上游调控因子,并重点关注 ZFP36,这是一种 RNA 结合蛋白,已知其可通过 3'UTR 中的富含 AU 的元件(尤其是 AUUUA 基序)介导 mRNA 降解(图 7A)。
对 CAF 进行相关性分析,鉴定出 735 个候选基因,这些基因均与 ZFP36 表达呈负相关,且包含 ≥ 5 个 ATTTA 基序(图 7B)。这些靶基因主要参与免疫相关通路(图 7C)。空间特征图显示了 ZFP36 与部分免疫调节基因(包括 FN1、FAP、INHBA、COL10A1 和 STC1)的表达模式(图 7D)。其中,FN1 与 ZFP36 的负相关性最强(图 7E)。来自四个独立样本的 LACE-seq 数据进一步证实了 ZFP36 与 FN1 3'UTR 的结合(图 7F)。为了进一步探究 ZFP36+CAFs的转录调控,应用SCENIC推断单细胞水平的转录因子活性,ZFP36 相关靶点的通路富集分析突显了其在 T 细胞活化和共刺激信号传导中的作用(图 7G)。
为了评估这种调控的免疫学作用,分析了 FN1与不同免疫细胞之间的相关性。 CAFs中FN1的表达与多种T细胞亚群呈正相关,尤其是活化的CD8+T细胞和γδ T细胞(图 7H )。细胞通讯分析表明,FN1+ CAFs与T细胞的相互作用更为广泛,主要通过整合素和免疫检查点相关基因的调控实现,如α5β1-FN1、CD86-CTLA4和TNFSF4-TNFRSF4(图 7I)。空间细胞间网络进一步证实,FN1+CAFs与细胞毒性T细胞亚群(包括CTL)的空间相互作用更强(图 7J)。这些结果表明,ZFP36则通过结合FN1基因的3′UTR并促进其mRNA降解,抑制CAFs介导的细胞毒性T细胞活化。
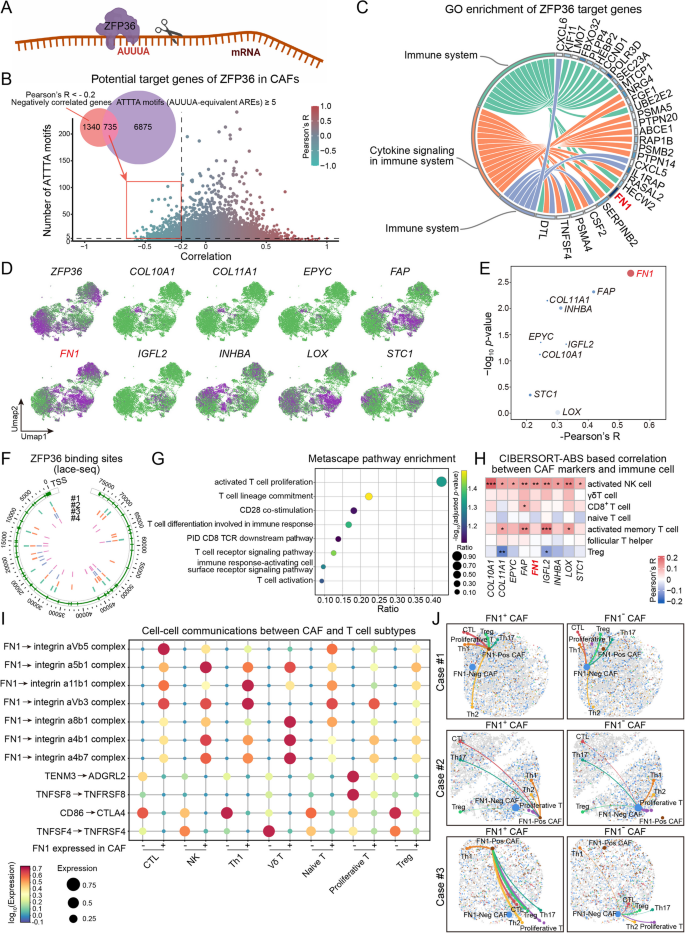
图7 ZFP36通过转录后抑制作用抑制幽门螺杆菌相关胃癌中FN1 + CAF介导的T细胞活化
和元多组学服务
和元生物提供多组学服务(如转录组、Astral蛋白组、代谢组、微生物组、Cut&Tag、MeRIP (m6A)-seq、WGBS、RRBS等)和单细胞及空间转录组服务(如10x单细胞转录组、10x单细胞转录组及TCR/BCR、墨卓单细胞转录组、DNBelab C-TaiM4单细胞转录组、CytAssist空间转录组、HD空间转录组、Stereo-seq 空间转录组等),致力于为广大生命科学家、医学工作者提供基于多组学的科研及临床应用解决方案。累计协助客户在Advanced Science、Journal of Nanobiotechnology、Advanced Functional Materials、ACS Nano、Nature Aging、Neuron等期刊发表SCI论文,并推出了广受好评的生信分析云平台,助您高效实现个性化数据挖掘!

更多活动详情可长按或扫描上方二维码,填写表单,我们将尽快安排专人与您联系!
和元生物:15800353038
和元生物技术(上海)股份有限公司(股票代码:688238)作为一家在科创板上市的高新技术企业,自2013年成立以来,始终深耕细胞和基因治疗核心领域,专注于为细胞和基因治疗的基础研究提供基因治疗载体研制、基因功能研究、药物靶点及药效研究等CRO服务,可提供①组学服务:常规转录组、单细胞转录组、基因组、代谢组及蛋白组等。②载体构建和病毒包装:质粒、siRNA、腺相关病毒(AAV)、腺病毒(ADV)、慢病毒(LVV)、逆转录病毒(RV)、单纯疱疹病毒(HSV)等病毒载体生产服务,提供R&D、实验室级别、GMP级别,满足研发、小动物、大动物NHP到临床的不同研究阶段的使用需求。③细胞实验服务:过表达、干扰稳定株构建,单克隆细胞株构建服务及细胞功能学、药效学实验服务。④动物实验及机制研究:神经、代谢、肿瘤动物模型、药效药代、病理切片及蛋白、核酸检测服务。⑤特色项目服务:CRISPR文库筛选服务,外泌体整体研究服务,AAV衣壳筛选服务、听力研究整体项目服务,满足客户定制化或一站式项目服务,助力基础科学研究,促进基础研究到临床转化应用,推动细胞和基因治疗行业发展。







