和元生物技术(上海)股份有限公司品牌商
14 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
公司新闻/正文
【On-target】AAV精准递送脑血管内皮细胞 | 血清型 · 启动子/增强子 | 一篇就GO了!
396 人阅读发布时间:2025-09-16 11:33
脑血管内皮细胞(Brain endothelial cells, BECs)是血脑屏障(blood–brain barrier, BBB)的关键结构和功能组成部分,它们通过tight junction (TJ) 和adherens junction (AJ) 结构中的特定蛋白紧密连接,严格调节血液与脑实质之间的物质交换,调节血管功能,维持中枢神经系统稳态。越来越多的研究表明,BECs功能异常与多种神经系统疾病密切相关,因此BECs也成为了治疗脑部疾病(中风、血管性痴呆、阿尔茨海默病 (AD)、多发性硬化症 (MS)、胶质母细胞瘤 (GBM)等)和进行脑科学研究的重要靶点。
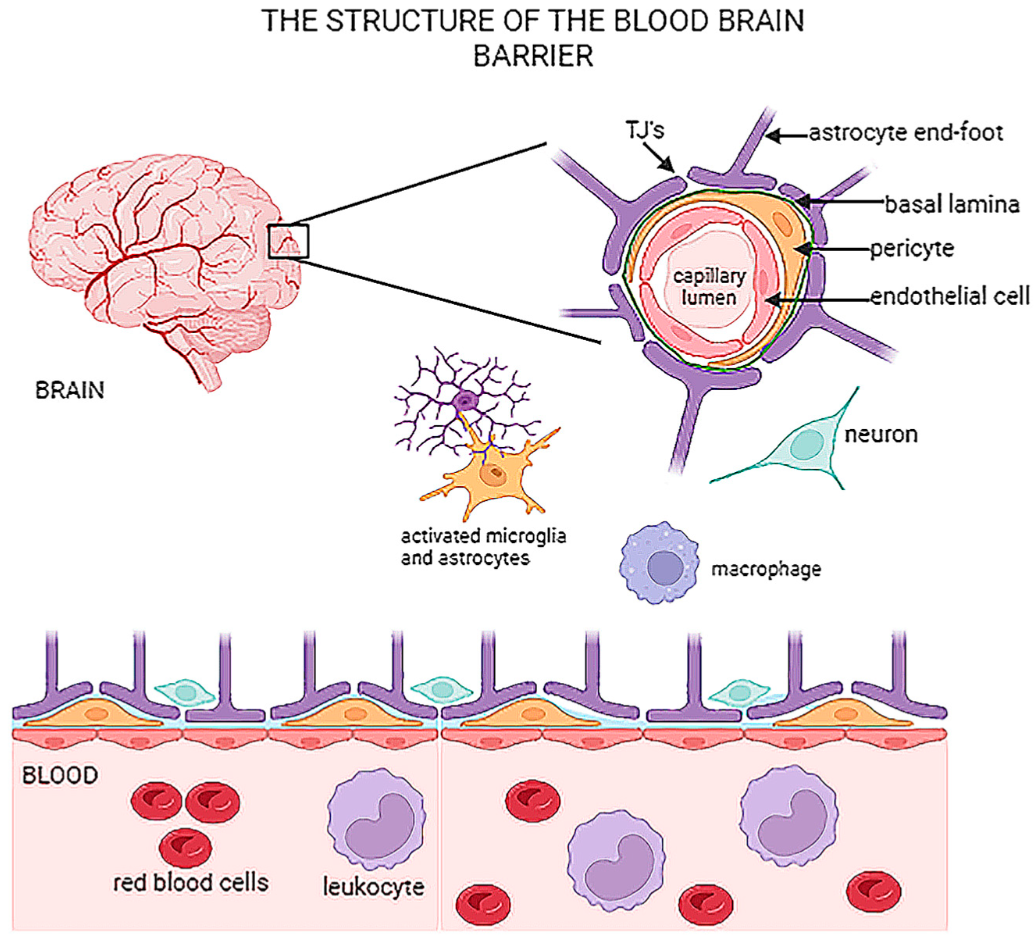
BBB结构及内皮细胞位置(PMID: 38786013)
近年来,重组腺相关病毒载体(recombinant Adeno-associated virus, rAAV)因低免疫原性和长期稳定的基因表达能力而成为基因治疗和神经科学前沿研究的热门载体。然而,传统AAV血清型在靶向BECs存在一定的局限性。因此,科学家们通过工程化改造和筛选,开发了一系列能够有效靶向脑血管内皮细胞的AAV血清型,为治疗相关疾病、调控血脑屏障通透性等方面提供了无限可能。今天就带大家盘点这些 “定制款” AAV载体,看看它们如何突破挑战,成为研究和治疗的利器!
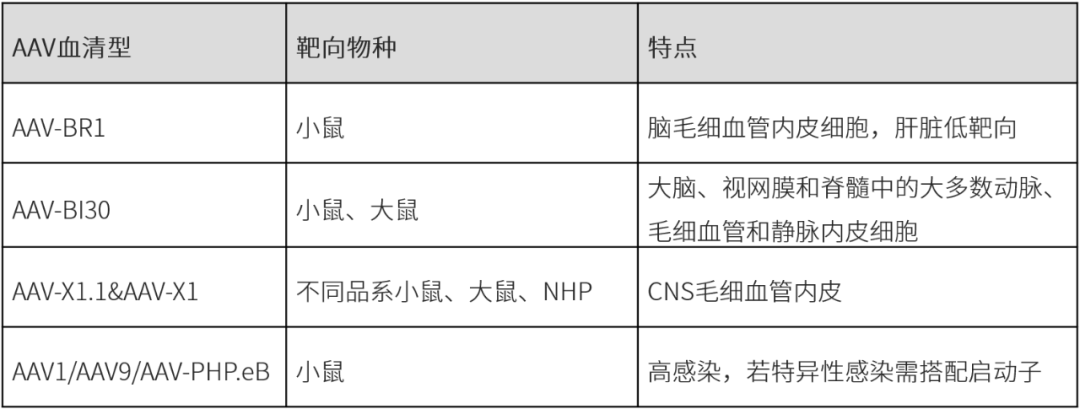
靶向BECs的AAV血清型
AAV-BR1
2016年,德国奥格斯堡大学附属医院Martin Trepel团队基于AAV2筛选开发的AAV-BR1,可以通过静脉注射高效特异的转导小鼠脑微血管内皮细胞,且具有肝脏低靶向性[1]。
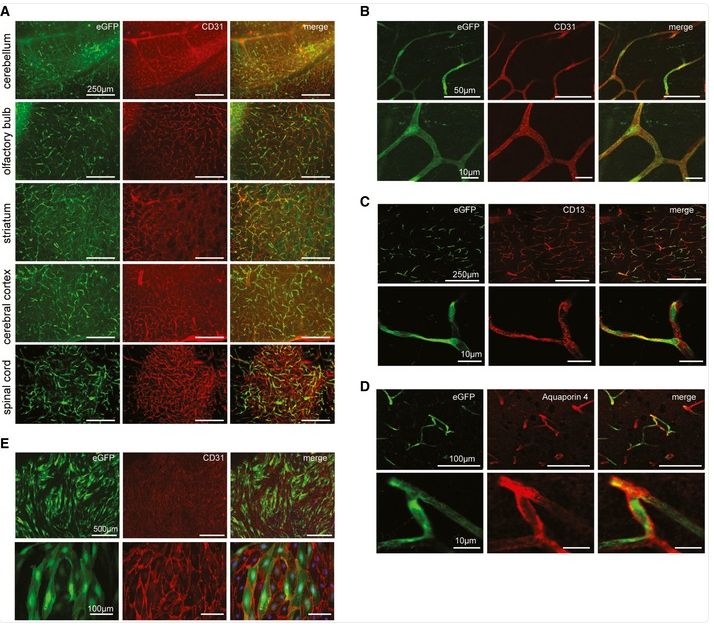
AAV-BR1-CAG-EGFP以1.8E11vg剂量尾静脉注射小鼠2周,主要感染脑、脊髓毛细血管内皮细胞,少量感染神经元和星形胶质细胞[1]。
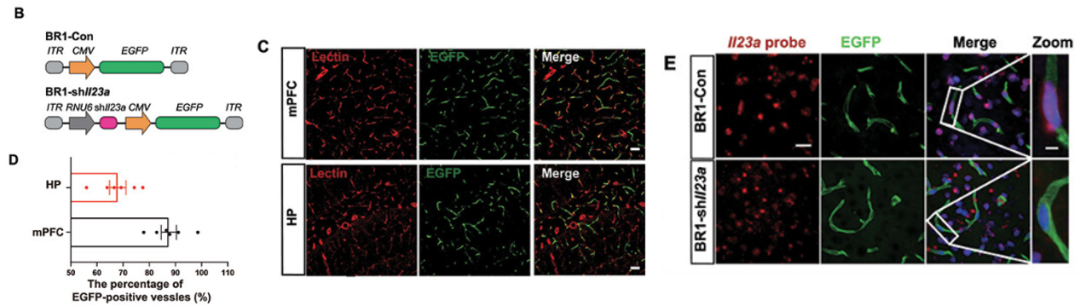
2023年1 月1日,南京医科大学基础医学院卢应梅教授课题组和药学院韩峰教授课题组合作揭示了脑血管内皮TFEB-STAT3-IL23A信号异常在小胶质细胞激活和认知功能障碍疾病进程中发挥了关键性作用。在研究中,研究者借助AAV-BR1递送shRNA以特异性敲低脑血管内皮细胞中的Il23a(AAV-BR1-sh Il23a),借助Lectin(血管内皮标志物)免疫染色发现EGFP在小鼠脑内皮细胞中特异性表达[2]。

AAV-BI30
2022年,美国麻省理工学院、哈佛大学博德研究所的Benjamin E. Deverman教授和哈佛医学院的Chenghua Gu教授合作基于AAV9筛选出AAV-BI30,可以通过静脉注射高效特异转导小鼠、大鼠CNS的内皮细胞,包括大脑、视网膜和脊髓中的大多数动脉、毛细血管和静脉内皮细胞。此外,加入肝细胞特异性microRNA靶序列miR122后,会降低肝脏富集[3]。
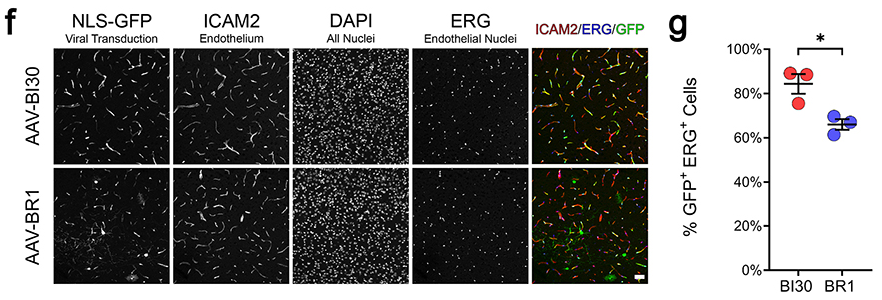
AAV-BI30-CAG-NLS-GFP-miR122-WPRE以1E11vg剂量静脉注射小鼠3周,>80%脑内皮细胞转导,具有高度BECs特异性。
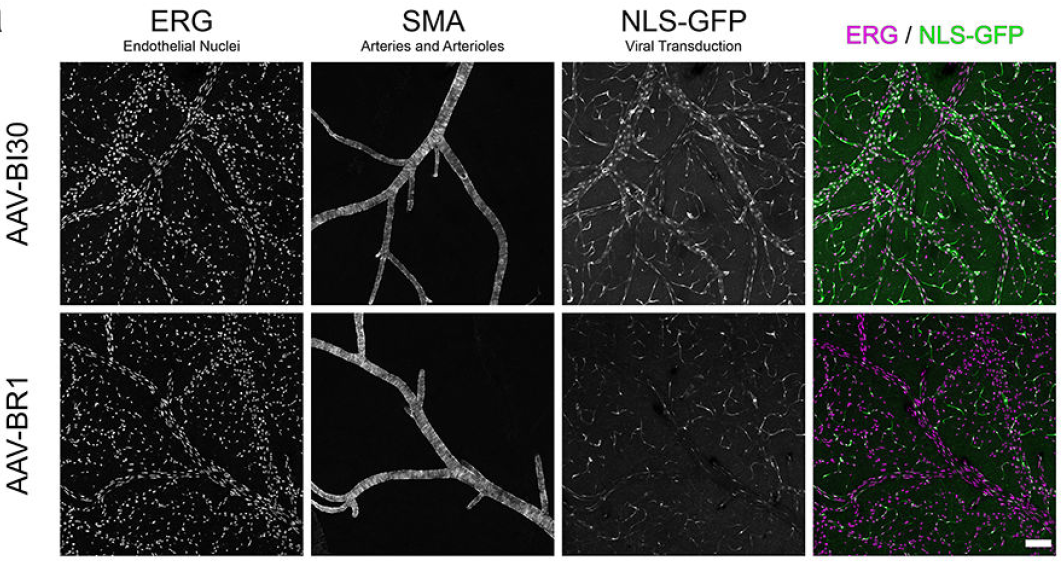
AAV-BI30对于大部分动脉和静脉内皮细胞也具有高特异性。
为评估AAV-BI30对于CNS内皮细胞的基因操纵能力,该团队进行Caveolin-1(Cav1,小窝蛋白,参与调节BBB完整性)体内敲除实验,将AAV-BI30-CAG-Cre-miR122-WPRE以1E11vg剂量静脉注射Cav1fl/fl鼠,结果显BECs中Caveolin-1表达显著降低,非内皮细胞(如血管平滑肌细胞)中Caveolin-1表达无明显变化。
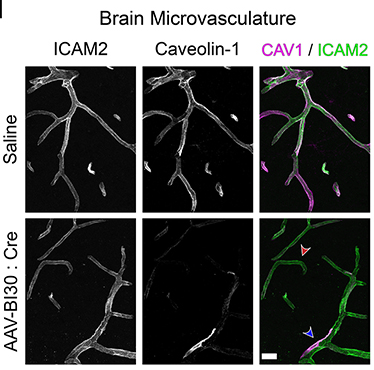
AAV-BI30-Cre具有BECs特异性
AAV9-X1.1&AAV9-X1
2023年,加州理工学院 Viviana Gradinaru 团队基于AAV9筛选出AAV-X1和AAV-X1.1,可以通过静脉注射高效靶向啮齿类动物(不同品系小鼠、大鼠)脑内皮细胞、非人灵长类动物(NHP,狨猴和恒河猴)的中枢神经系统(CNS)以及离体恒河猴和人脑片[4]。
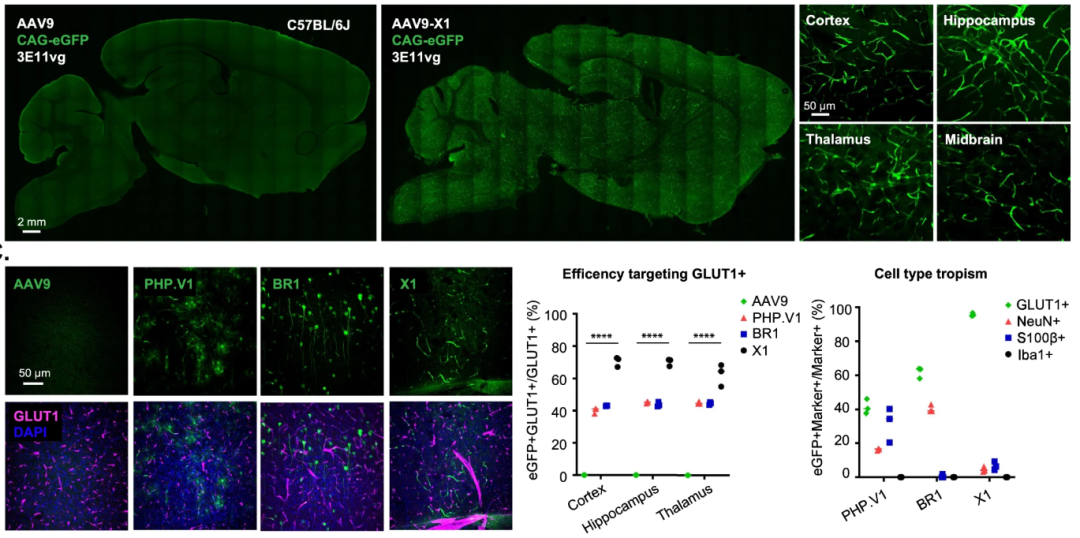
AAV-X1-CAG-EGFP以3E11vg剂量静脉注射小鼠3周,对于脑内皮细胞具有高效且特异性。
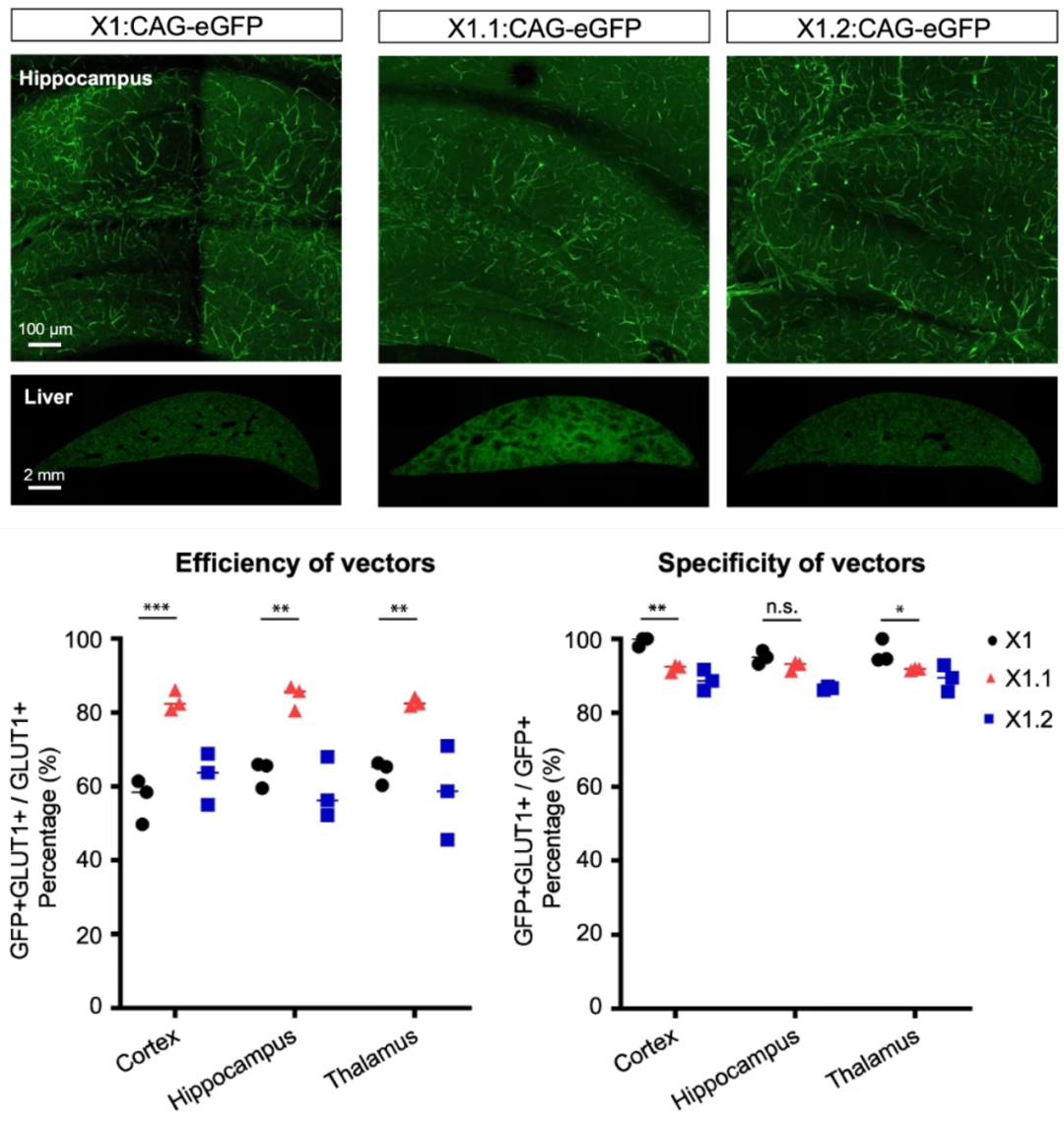
AAV-X1.1表现出更高的脑内皮细胞特异性转导。
SPARCL1/Hevin下调或错义突变参与多种神经系统疾病如自闭症、精神分裂症和抑郁症有关,Hevin敲除鼠(Hevin KO)表现出VGluT2+丘脑-皮层环路突触丢失现象。为进一步评估AAV-X1.1在BECs的特异性基因调控能力以及BECs特异性表达Hevin是否能改善Hevin KO鼠缺陷,该研究团队将AAV-X1.1-CAG-Hevin-EGFP以1E12vg剂量经眶后静脉注射Hevin-KO小鼠,3周结果显示:Hevin特异性在脑内皮细胞中高表达,并改善了Hevin KO鼠丘脑-皮层环路突触丢失现象。
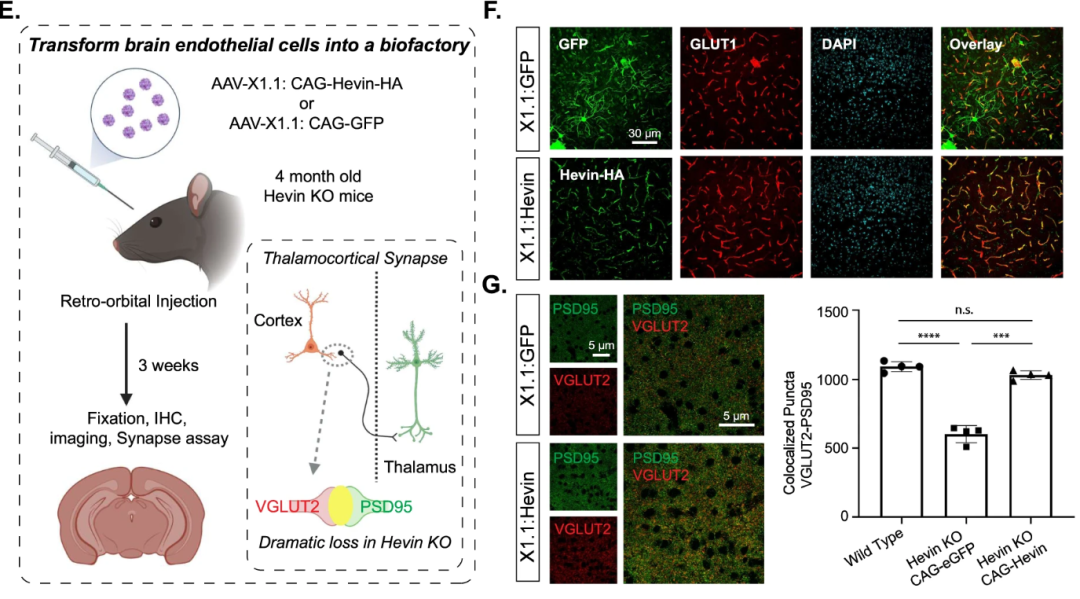
AAV-X1.1介导Hevin特异性在脑内皮细胞中高表达,并改善了Hevin KO鼠丘脑-皮层环路突触丢失现象
除上述靶向脑血管内皮细胞的AAV新血清型外,Viviana Gradinaru 团队之前基于Cre以来的AAV靶向筛选平台开发的AAV-PHP.V1可以靶向BECs。天然血清型AAV1被报道用于视网膜内皮细胞感染[5],AAV-PHP.eB可以感染CNS内皮细胞。此外,可亦有越来越多的靶向血管内皮(ECs)的新型AAV载体的研究正在不断取得进展,比如基于AAV2改造的AAV-Vec和AAV-Sig常用于体内外ECs转导。
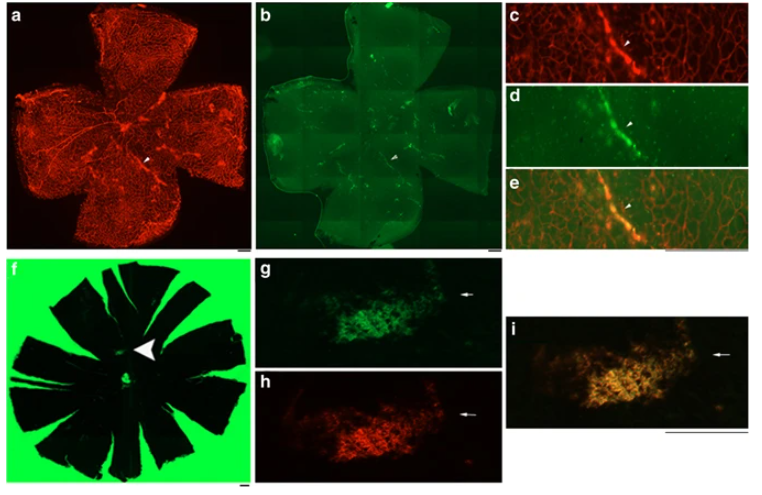
借助AAV1-CRISPR系统在小鼠视网膜血管内皮编辑VEGFR2(血管内皮生长因子受体2),改善眼内病变的血管生成[5]。

总结
靶向ECs的启动子/增强子
即使是上述靶向性较强的AAV血清型,也可能存在“脱靶”现象(如泄露到神经元或者星形胶质细胞),这时可以借助Tie1/Tie2(Tek)、Cdh5(CD144)、ICAM2、hFLT1等内皮细胞特异性启动子、以及Ple32/CLDN5、ple261等视网膜内皮细胞启动子进一步提升特异性。此外,2025年加州大学尔湾分校(UCI)徐向民团队开发一套高特异性标记脑血管内皮细胞的增强子工具集,其可以通过静脉注射高效特异靶向BECs,且具有肝脏低靶向性[6]。
增强子序列是调控基因特异性表达的关键元件,利用特定的增强子可以驱动外源基因在对应细胞类型中的表达。该团队分别借助AAV-PHP.eB和AAV-BR1血清型搭配BEC增强子(BEC-enhancer)以3E11vg剂量经眶后静脉注射成年小鼠,发现BEC-enhancer AAV可以更高效特异的靶向脑血管内皮细胞[6]。
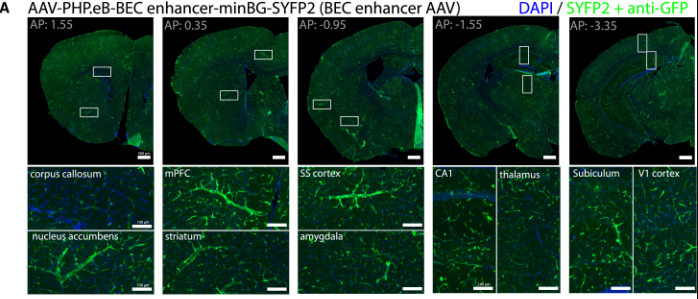
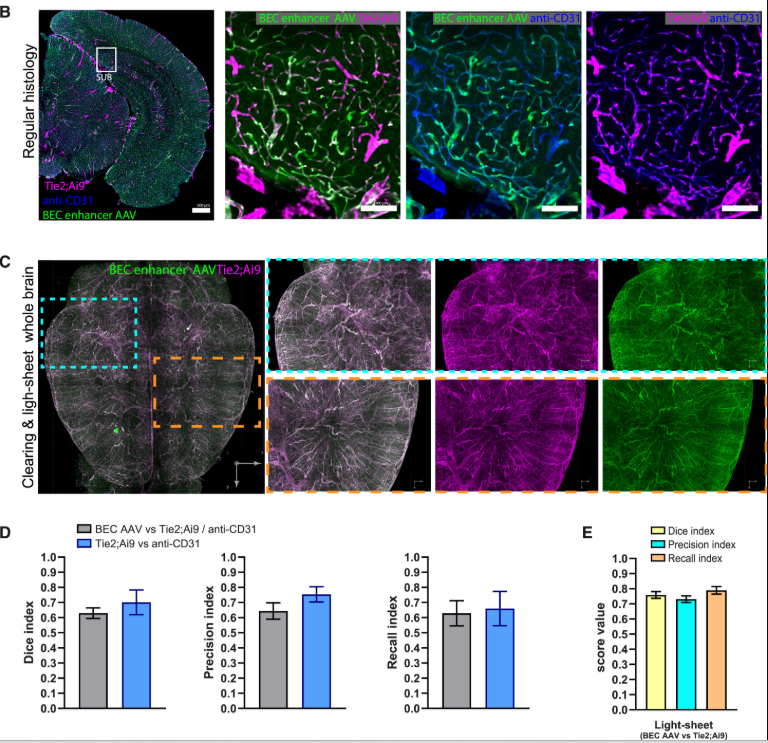
BEC-enhancer AAV可以更高效特异的靶向脑血管内皮细胞
hFLT1
hFLT1基因编码血管内皮生长因子受体1,表达于内皮细胞。2025年兰州大学余静教授在CNS Neuroscience & Therapeutics杂志发表关于高血压诱导脑血管内皮屏障功能障碍分子机制的文章。研究中作者借助AAV-BR1血清型配合hFLT1启动子特异性在BECs中下调Rnf40表达,发现Rnf40敲低改善了脑血管内皮屏障功能障碍[7]。
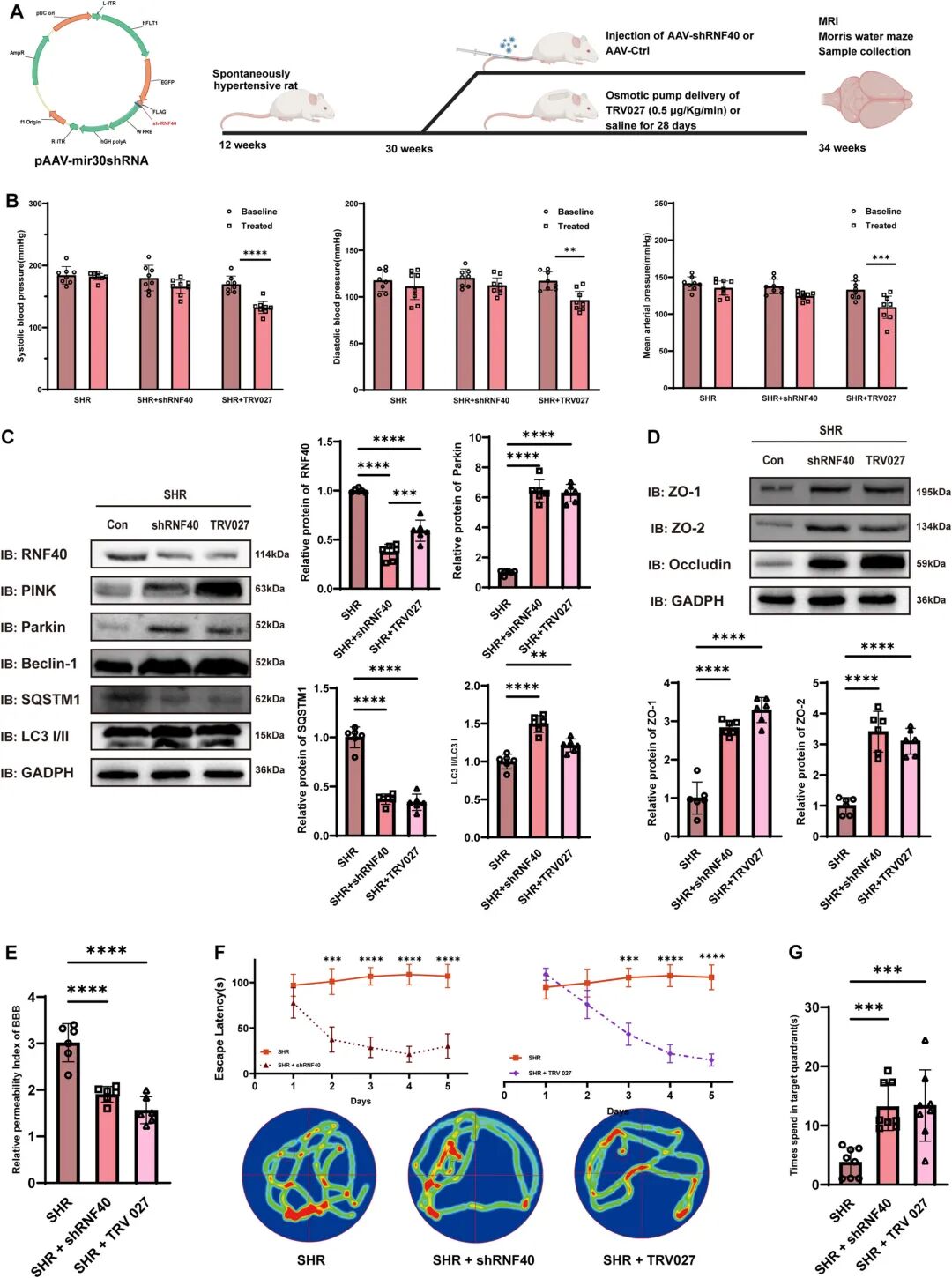

TIE1和TIE2(Tek)
TIE1和TIE2(Tek)是一种血管生成素受体,是酪氨酸蛋白激酶家族的一个成员,主要在内皮细胞中表达,在血管生成和血管稳定性中发挥关键作用。2024年南京医科大学附属第一医院蔡卫华教授团队在Cellular and Molecular Life Sciences发表关于脊髓损伤后血管生成和血脊髓屏障功能恢复分子机制的文章。研究中作者借助AAV-PHP.eB血清型搭配tie2启动子特异性在内皮细胞进行Sox17基因调控,并发现内皮细胞特异性表达 Sox17 可促进小鼠脊髓损伤后内皮细胞再生和功能恢复[8]。
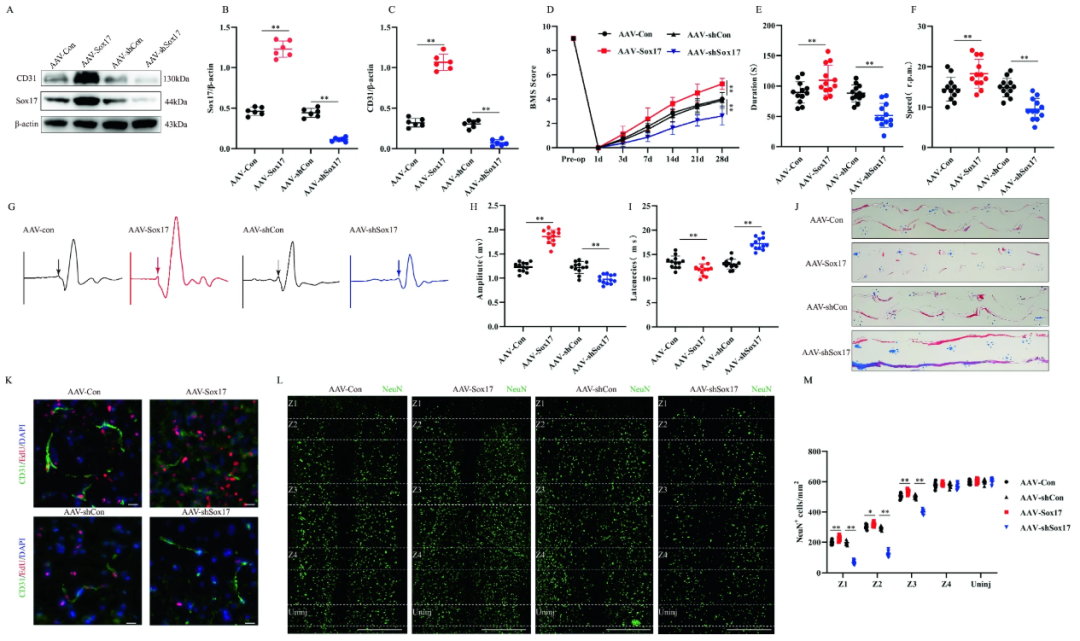

Cdh5(CD144)
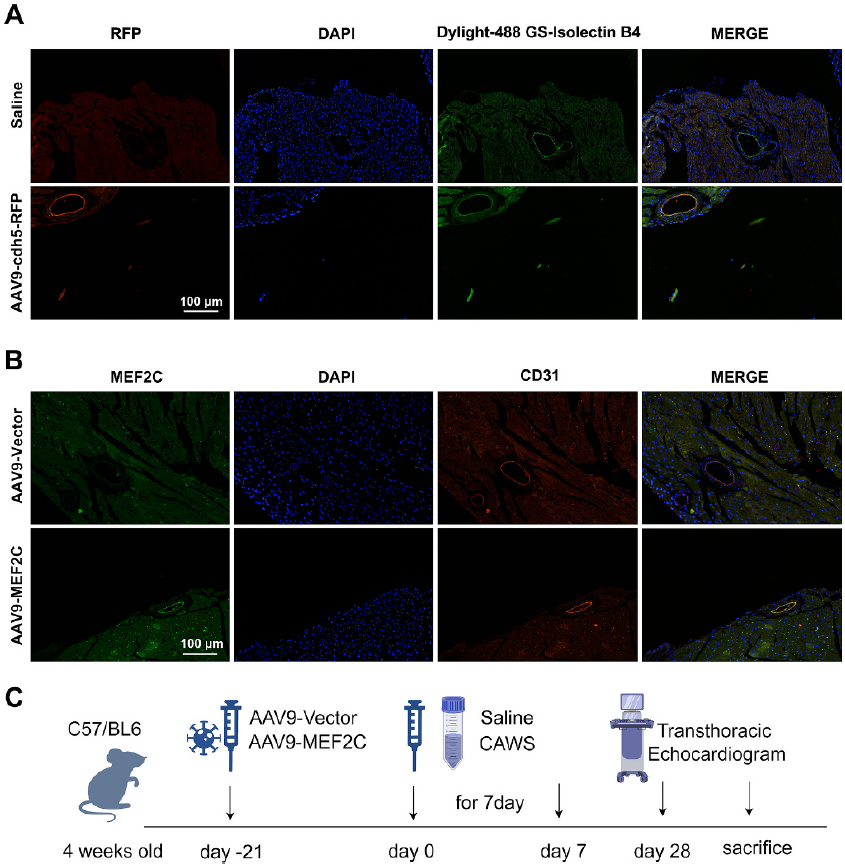
Cdh5(也称CD144)是一种血管内皮钙粘蛋白,对于血管的正常发育必不可少。Cdh5启动子也可作为血管内皮细胞特异性启动子。2025年,温州医科大学附属第二医院的研究团队在International Immunopharmacology发表关于川崎病引起的冠状动脉病变的研究。研究人员借助AAV9-Cdh5-MEF2C,在小鼠体内血管内皮细胞中过表达MEF2C[9]。

现阶段的研究通常采用强效AAV血清型+特异启动子策略,此外,研究发现,对比脑定位注射和侧脑室注射(会泄露到神经元和胶质细胞),静脉注射可以更特异性更高效转导BECs。随着基因工程技术的发展,更多具有更高效率、更强特异性、更低免疫原性的新型AAV衣壳和启动子正在被开发出来。靶向BECs的AAV技术,不仅为基础研究提供了强大工具(如研究基因功能、构建疾病模型),更在临床治疗中展现出巨大潜力。
和元生物可提供上述所有的靶向BECs的AAV血清型和特异性启动子/增强子,为靶向脑血管内皮细胞的基因递送提高更高效更精准的载体,助力基础科学研究!
业务咨询:15800353038









