和元生物技术(上海)股份有限公司品牌商
14 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
公司新闻/正文
PNAS | ApoE-Trem2 信号通路介导了小鼠急性脑缺血的小胶质细胞激活
228 人阅读发布时间:2025-09-12 09:38
缺血性中风主要的病理生理过程是神经元死亡,同时伴有由免疫细胞和激活的驻留细胞介导的广泛炎症反应。激活的驻留神经胶质细胞表现出一系列促炎和抗炎特性,其有害和有益作用主要由时间和空间因素以及与其他细胞类型的相互作用决定。
近期在PNAS上发表题为“Spatiotemporal transcriptomic map of glial cell response in a mouse model of acute brain ischemia”的研究。为了解析缺血后发生的关键分子作用和细胞变化过程,对雄性小鼠大脑进行了空间转录组和单细胞转录组分析。在皮质中基因变化明显,表现为炎症和细胞死亡,及由周围多种细胞类型协调的胶质瘢痕的形成。胶质瘢痕被确定为具有强烈细胞间通讯的区域,其中突出的是 ApoE-Trem2 信号通路介导的小胶质细胞活化。
关键研究结果
01 缺血性脑损伤严重改变了皮质的基因表达特征
为了全面了解缺血损伤后的全转录组表达,对 3 月龄雄性的MCAO脑缺血小鼠进行了空间转录组(10× Genomics Visium)分析。重点关注了四个时间点:无损伤 (ctrl) 以及损伤后第 1、3 和 7 天 (DPI)(图 1 A-B)。空转的整合和聚类重现了大脑解剖结构并揭示了病变区域的表达多样化,病变主要按时间(ISD1、ISD3 和 ISD7)分隔,其次按病变内的中心(c)或周围(p)位置分隔(图1C和D)。
虽然各个切片的皮质区域大小相似(约 1,000 个点),但病变区域分别从52% 减少到 40%,最终减少到 25%,与MRI 结果一致(图 1E )。损伤动态也反映在每个点检测到的基因数量上,随着时间的推移,基因数量逐渐增加(图 1 F)。尽管有这种增加,但损伤基因数量仍然低于未损伤皮质,表明转录表达和细胞组成发生了变化。
为了描述各个时间点和病变位置之间的相似性和差异性,计算了 DEG。DEG 随着时间的推移而增加,但在第一周内几乎没有直接恢复到未受伤的皮质状态(图 1 G )。许多 DEG 仅出现在特定时间点或位置,尤其是 7DPI 病变。总体而言,缺血性损伤导致皮质转录谱发生了明显变化,核心区病变明显,突显了缺血诱发过程的时间和空间性质。
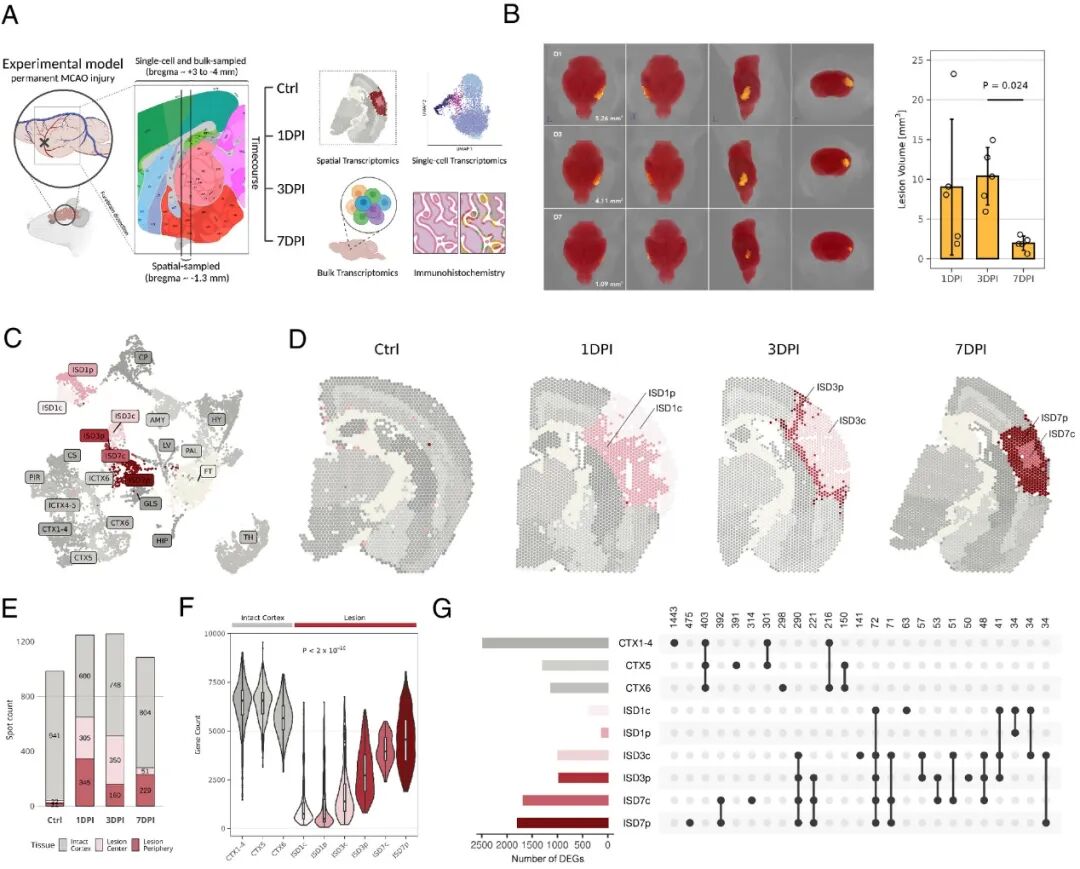
图1缺血损伤小鼠的空间转录组表达特征
02 缺血性病变扰乱了皮质的生物学功能及其细胞的空间组成
为了表征缺血性损伤中不同区域的功能,对DEG进行了富集分析,并可视化了上调基因参与生物过程 (BP)的调控网络 (图 2 A )。第 1 天,与细胞迁移、粘附、细胞因子、细胞活化和与创伤反应相关的生物学过程显著富集,反映了外周免疫细胞的浸润和活化增加,且大多数主要在病变中心激活。到第 7 天,大多数过程(包括炎症)重新定位到病变中心,其中神经胶质生成、轴突鞘化和突触修剪在周围更为明显,表明出现了最初的神经重组迹象。
使用RCTD来反卷积解析细胞类型组成。损伤极大地改变了皮质细胞组成(图 2B )。病变区域显示神经元明显减少,但被神经胶质细胞、外周免疫细胞、成纤维细胞和血管细胞在时间和空间上独特的积累所抵消(图 2C)。在第 1 天,神经元含量从中心到周围逐渐减少,表明损伤逐渐扩大。第 3 天神经元几乎完全丢失,但到第 7 天有所改善,周围神经元含量增加。
反卷积分析还捕获到了显著的胶质细胞增生和分化,包括星形胶质细胞、少突胶质细胞和小胶质细胞(图 2D)。第 1 天,少突胶质细胞在严重损伤的病变周围按比例增加,病变边界由小胶质细胞组成。小胶质细胞与趋化因子(Ccl3、Ccl4、Ccl12,图 2E)的共定位,表明了其在吸引和激活浸润性外周免疫细胞和其他胶质细胞方面发挥了作用。第 3 天,髓样细胞和内皮细胞在病变组成中占主导地位。到第 7 天,消退的病变大部分由髓系细胞组成,病变周围由星形胶质细胞和少突胶质细胞组成。有趣的是,这些胶质细胞群与各种神经病理学状况中发现的胶质细胞标志物有很好的相关性,例如星形胶质细胞中的Gfap、Vim、Mt1以及少突胶质细胞中的Serpina3n、C4b、Klk6 (图 2 F )。
总而言之,缺血性病变的功能和细胞特征揭示了深刻的炎症反应,随着时间的推移,其空间定位明显。这种反应伴随着细胞类型组成的变化,最初是外周免疫细胞和血管细胞,后来是神经胶质细胞和成纤维细胞。神经胶质细胞逐渐被激活,形成包裹缺血核心的神经胶质瘢痕。

图2缺血性损伤扰乱了生物学功能变化及其细胞的空间组成
03 细胞通讯分析发现病变周围神经胶质细胞导向串扰增加
接下来,重点研究了病变周围的相互作用,以阐明胶质瘢痕形成中涉及的细胞互作。由于小胶质细胞的比例不断增加,它们成为更频繁的信号发送者和接收者(图 3 A),表明了其在神经胶质疤痕形成中的重要性。其中整合素受体Itgb1、Itgb2 和 Itgam是最受关注的受体之一,与细胞粘附(Tln1、Jam3、Spp1)、运动(Hmgb1、Cx3cl1)和先天免疫反应(Tgfb1、Cd14、Lgals3、Lgals3bp)相互作用(图 3B)。小胶质细胞不仅接收信号,而且还主动指示其他细胞(特别是少突胶质细胞)增强粘附(Tgfb1-Itgb1、Lgals3bp-Itgb1)或乳酸释放(Bsg-Slc16a1,可能有助于小胶质细胞代谢重编程)。
尽管整合素导向的 LR 通讯明显,但病变周围的主要相互作用是Apoe-Trem2(图 3B)。在第 7 天,从对照皮质到病变周围,小胶质细胞导向的Apoe-Trem2对增加了 100 倍以上(图 3C )。此外,观察到了Apoe-Trem2共表达(图 3D ),表明由于轴突连接受损导致继发性小胶质细胞活化。为了阐明Apoe -Trem2的直接效应,收集了其 LR 靶向信号网络基因进行富集分析。小胶质细胞Apoe-Trem2参与了细胞活化 (ERK1/2 级联、葡萄糖代谢、细胞因子产生)、碎片清除 (蛋白酶体复合物、神经元凋亡)、细胞形态 (神经胶质生成、组织重塑) 和化学吸引 (趋化性、细胞因子产生) 的调控 (图 3E )。随后使用bulk RNA seq和免疫染色进行湿实验验证,小胶质细胞密度和体积的增加与病变中Apoe的升高相吻合(图 3 H),证实了 ST 数据中看到的积累。总之,揭示了病变周围神经胶质瘢痕形成的关键配体-受体相互作用,其中Apoe-Trem2占主导地位,突出了其在调节小胶质细胞活化中的作用。
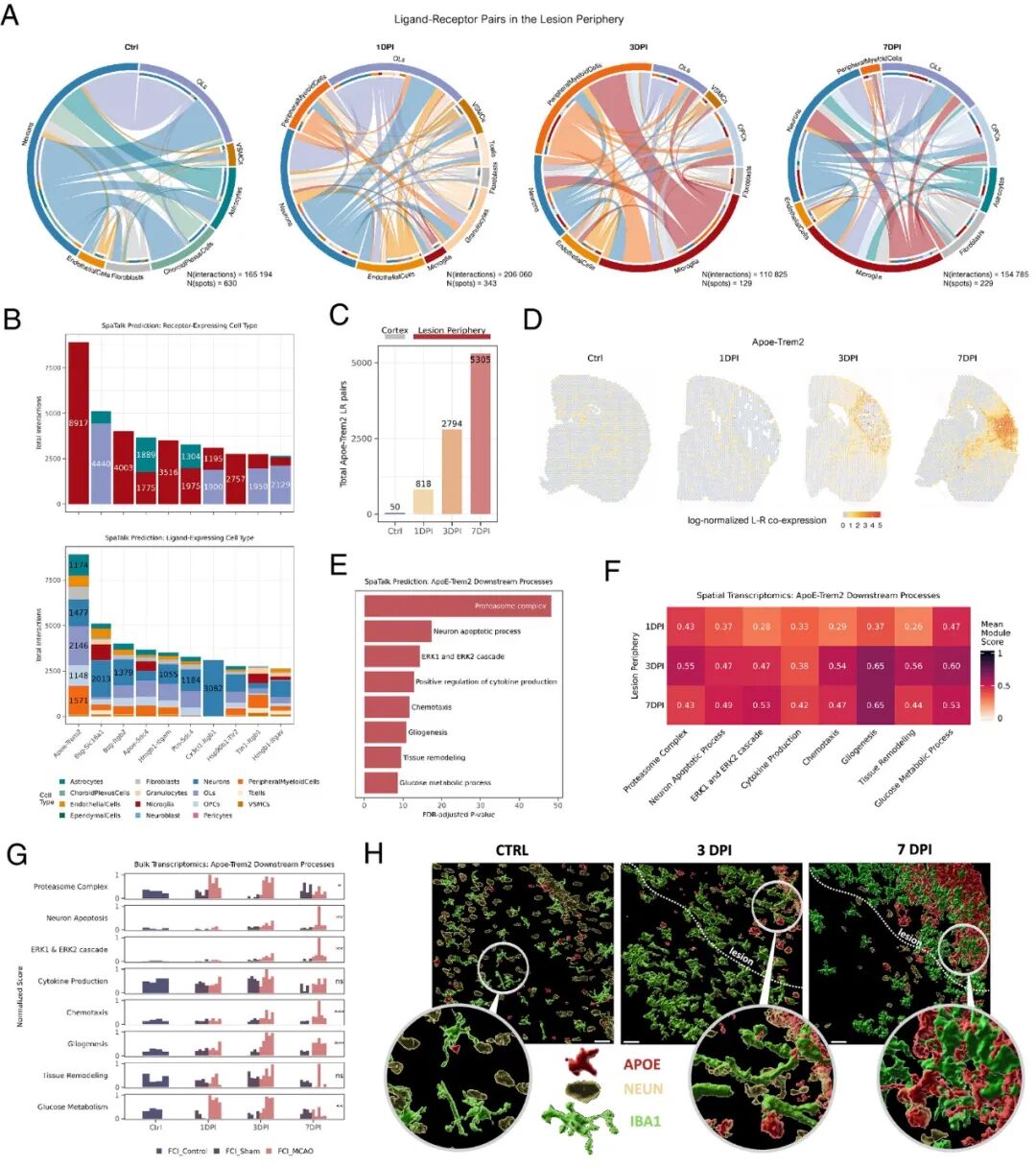
图3 Apoe-Trem2 是病变周围缺血后神经胶质增生的重要影响因素
04 单核转录组证实了反应性胶质细胞的存在
为了阐明Reactive glia是否存在于缺血性脑中,对第 1、3 和 7 天的缺血损伤后的脑组织(图 1 A)进行单核 RNA 测序 (snRNA-seq)。获得了 7,946 个高质量细胞核,鉴定到了11 个主要细胞类型,包括谷氨酸能和 GABA 能神经元、神经母细胞以及室管膜细胞、血管细胞和神经胶质细胞等。其中在Astroependymal中,鉴定到了Neuroblasts(Dcx)、Choroid plexus cells(Tmem72)、室管膜细胞(ependymal cells,Foxj1)和四个星形胶质细胞群(图 4 A)。
活化的星形胶质细胞(Activated astrocytes)高表达能量代谢(Cox8a、Aldoc)和参与神经元维持和存活(Shank1、Nrgn)的相关基因(图 4 B)。Reactive astrocyte 表现出反应状态,反应性(Gfap、Apoe、Clu)、细胞粘附(Cd9、Ptn)、增殖(Vim、Thbs4)、溶酶体活性(Ctsd)等高表达。免疫染色证实了 ALDH1L1+GFAP+ 星形胶质细胞在病变周围的定位及其在缺血后的富集 (图 4 E )。
小胶质细胞分为稳态 ( P2ry12 ) 和反应性 ( Apoe, Spp1 ) 这2类主要的细胞群(图 4 F )。反应性小胶质细胞过表达与细胞迁移、增殖、粘附 ( Gpnmb、Sash1、Lgals3 )、蛋白质分泌 ( Spp1、Igf1 )、组织重塑 ( Hif1a ) 和脂质转运 ( Abca1 ) 相关的基因。空间映射反应了Reactive astrocyte在第 1 天和第 3 天在病变周围积聚,然后扩展到病变中心(图 4 I)。IBA1 和反应性 CTSb 标记物的免疫染色证实了病变周围存在 IBA1+CSTb+ 小胶质细胞及其在缺血后富集(图 4 J)。总而言之,snRNA-seq 证实了缺血后Reactive glial细胞群的出现,且免疫染色验证了其在病变区域中的定位。

图 4神经胶质细胞在脑损伤后获得反应状态
05 缺血性脑损伤后出现一系列反应性少突胶质细胞
使用相同的实验设计,从对照和缺血性大脑中富集了Plp1+细胞并进行了单细胞 RNA 测序 (scRNA-seq)。经过质量控制后,获得了 4,573 个高质量的少突胶质细胞(oligodendrocytes,OLs)。共鉴定了2个成熟的 Ols细胞群【MOL2 (S100b,Hopx ) 、 MOL5/6 (Ptgds,Opalin )】、 1个NFOL细胞群 ( Tcf7l2,Prom1 )、3个MOL 细胞群(MOL IFN、MOL DA1 和 MOL DA2) (图 5 A和B )。
MOL IFN的功能特征是与干扰素反应(Ifi27、Ifi27l2a)和 MHC I 类抗原呈递(H2-D1、B2m)相关(图 5C和D );该群体还上调表达与内吞作用(Trf、Gsn)和细胞粘附(Cd9、Cldn11)相关的基因。MOL IFN的空间表达逐渐增强,从侧脑室沿着病变周围扩展到胼胝体和更深的纤维束(图 5E )。在第 7 天,特征环绕着病变核心,表明与形成神经胶质瘢痕的其他细胞发生串扰。
MOL DA1高表达Serpina3n 、C4b和Klk6;此外,其在髓鞘形成和细胞骨架重组中发挥作用(高表达Arpc1b、Tubb3)(图 5 C-D)。其他标志物的高表达表明MOL DA1可以调节细胞外丝氨酸蛋白酶活性(Serpina3n、Klk6)、细胞粘附(Cd9、Cd63)、金属离子稳态(S100a6、S100a16、Calm2、Trf)和增强脂质代谢(Apod、Fabp5)。在空间上,MOL DA1集中在病变周围的胼胝体中,并在第 7 天包围病变区(图 5 E)。
最独特的群体 MOL DA2中与翻译起始(Eif1、Eif4a1)、蛋白折叠(Cct2、Cct5)相关的基因上调;还与代谢(Cox5a、Atp5a1)和肽酶活性调节(Serpina3n、Ctsb、Ctsd、Timp1)相关(图 5 C-D)。此外,与应激(Fos、Jun)、细胞周期调控(Cdkn1a)和凋亡(Gadd45b、Tnfrsf12a、Tnfrsf1a、Ddit3)相关。值得注意的是,髓鞘形成基因(Plp1、Mog、Mag) 下调,表明髓鞘形成能力降低。MOL DA2 的空间表达在第 1 天在侧脑室附近的胼胝体中很突出,随着时间的推移而减少(图 5 E)。
为了验证这些细胞群的存在,将Plp1与 B2M(MOL IFN)、SERPINA3N(MOL DA1)和 TNFRSF1A(MOL DA2)在小鼠冠状脑切片中进行共染色定位,双阳性细胞在对照中很少,但逐渐增加,在第 7 天达到峰值(图 5F )。与 ST 一致,共定位信号在病变周围即神经胶质瘢痕形成的区域积累。总之,结合 scRNA-seq 可确定缺血后一系列反应性少突胶质细胞群。这些细胞群虽然具有减少神经炎症的潜力,但有其独特的免疫原性和代谢表达谱。

图 5缺血损伤会诱导一系列反应性少突胶质细胞群
06 已发布 ST 数据集重现了缺血性病变周围神经胶质突出的情况
接下来,回顾性分析了其他与缺血相关的ST数据集(图6A)。在Han等人的研究中,病变跨越了多个区域,在1.2mm的最小距离内将其分为核心和外围(图6B)。同样,在Scott等人的研究中,最早的时间点显示病变分为核心和外围(图6B)。
研究了与病变周围神经胶质积聚相关的表达模式的时间和空间定位,计算了Ccl12、Ccl3和Ccl4趋化因子的表达富集和Apoe-Trem2的配体-受体相互作用。趋化因子集中在病变区域,主要在早期时间点(图6C),Apoe-Trem2在病变中显著上调,空间梯度向核心-外围边界增加(图6C)。
与未受伤的皮质相比,病变区域中三种神经胶质细胞群的反应特征显著富集(图6E)。小胶质细胞反应特征形成了核心-外围边界的胶质瘢痕内层,反应性星形胶质细胞和少突胶质细胞特征积聚在小胶质细胞层外。总之,病变核心-外围边界是趋化因子表达和Apoe-Trem2共表达的积累部位,反应性胶质细胞特征显著上调。
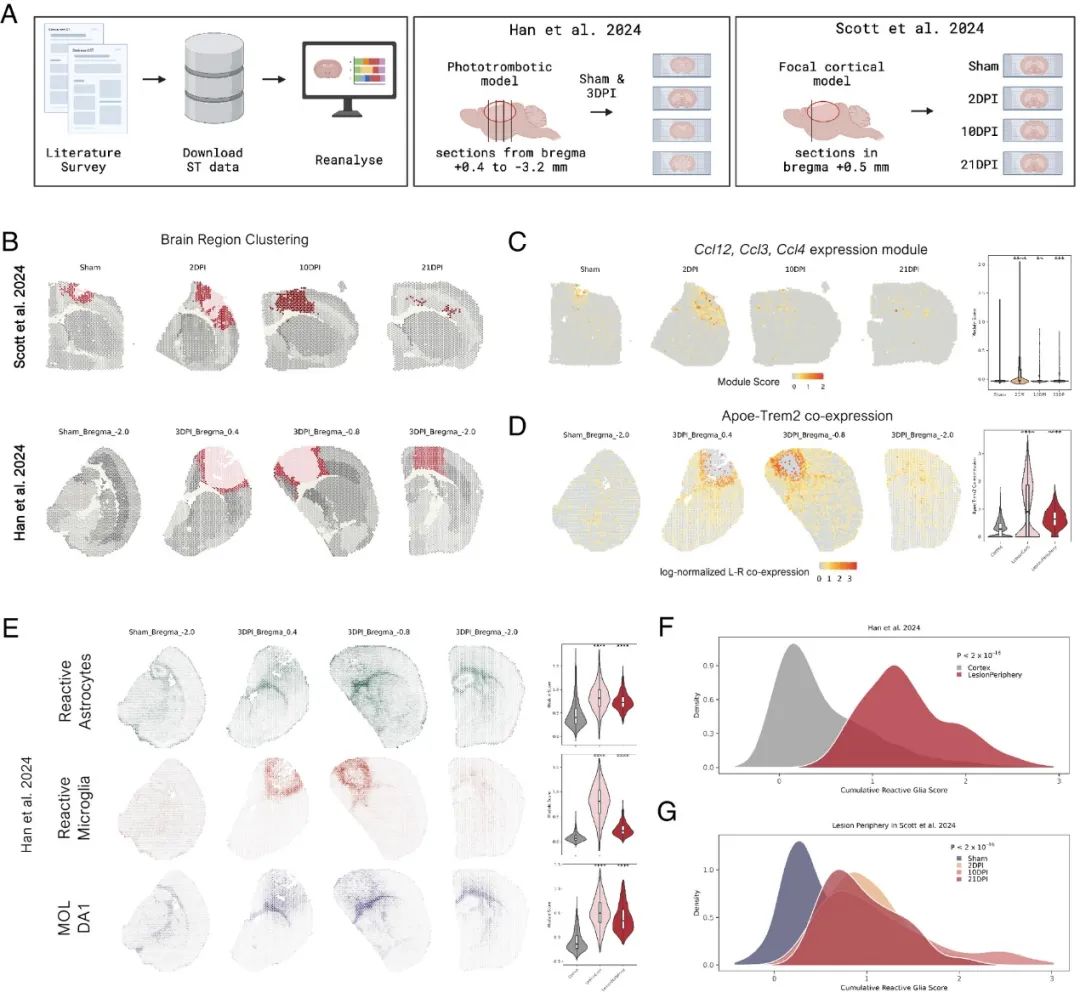
图 6公共缺血ST数据集的再分析
OBiO Services
和元服务
和元生物提供多组学服务(如转录组、Astral蛋白组、非靶向代谢组、表观组和微生物组等)和时空组学服务,如单细胞转录组测序(10x、墨卓等多平台scRNA-seq /snRNA-seq)和空间转录组测序(10x Visium、10x CytAssist、10x Visium HD、10x Xenium),助力您的科研研究!
业务咨询:15800353038









