和元生物技术(上海)股份有限公司品牌商
13 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
公司新闻/正文
研究应用篇 | 单细胞转录组在胃癌研究中的应用
178 人阅读发布时间:2025-09-10 13:54
胃癌(gastric cancer, GC)发病率居全球常见癌症第五位,死亡率居第三位。随着单细胞RNA测序(single-cell RNA-sequencing, scRNA-seq)技术的发展,对GC的研究已经开始逐渐从组织病理学水平发展到单细胞转录水平。scRNA-seq可在单个细胞水平上对基因组、转录组等进行分析,可识别胃癌组织中的罕见细胞亚群,有助于解析胃癌的发生发展轨迹。
将单细胞测序应用于探索胃癌免疫微环境、免疫治疗对肿瘤微环境的影响、上皮细胞/肿瘤细胞异质性等的相关文献进行解读,期望为大家的单细胞研究带来新的视角和启发~
研究案例一
文章题目:Single-cell transcriptional analyses of spasmolyticpolypeptide-expressing metaplasia arising from acute drug injury and chronic inflammation in the stomach
发表期刊:Gut (IF23)
发表时间:2019年
组学技术:单细胞转录组
实验设计:对照组小鼠(BALB/c);药物诱导型小鼠(HDT);炎症诱导型小鼠(TxA23)
解痉多肽表达化生(spasmolytic polypeptide expressing metaplasia,SPEM)是发生于胃体部的胃黏膜化生型病变,并被认为是可能的胃黏膜组织癌前病变之一。研究的目的是在单个细胞水平上定义与 SPEM 相关的转录变化,以响应胃粘膜中的急性药物损伤和慢性炎症损伤。从BALB/c、HDT、TxA23的胃中分离出上皮细胞并进行单细胞 RNA 测序 (scRNA-seq)。揭示了健康胃细胞中存在Muc6+ Gif+ cells,但这些细胞不表达与 SPEM 相关的转录本。此外,对急性药物损伤和慢性炎症损伤的 SPEM分析发现:(1)SPEM 和neck cell hyperplasia/hypertrophy的表达几乎相同;(2)尽管药物损伤和慢性发炎炎症损伤介导的转录变化几乎相同,但在慢性炎症环境中,SPEM 细胞诱导的涉及免疫调节的转录本是无可比拟的。
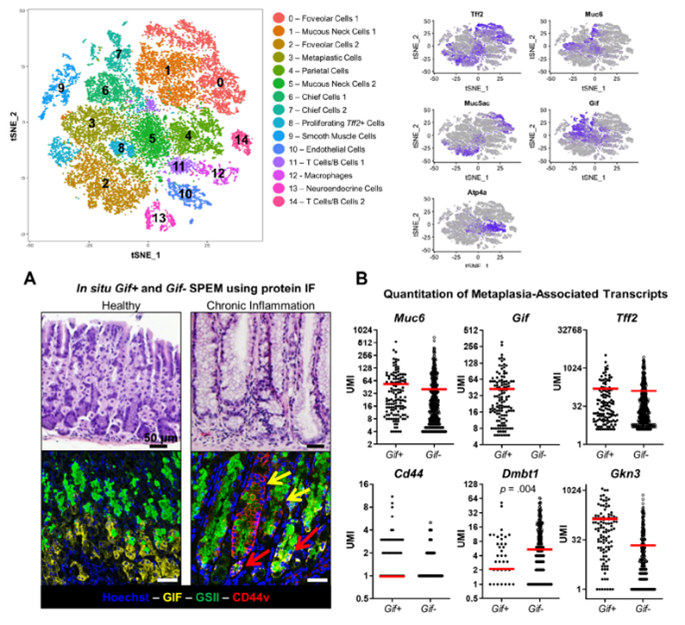
研究亮点:通过scRNA-seq发现SPEM相关的转录变化,鉴定到了新的细胞类型(Muc6+ Gif+ cells),并发现了慢性炎症损伤 SPEM中参与免疫调节的无可比拟的转录本。
研究案例二
文章题目:scRNA-seq of gastric tumor shows complex intercellular interaction with an alternative T cell exhaustion trajectory
发表期刊:Nat Commun(IF14.7)
发表时间:2022年
组学技术:单细胞转录组,免疫组库(TCR+BCR)
实验设计:血液样本(n=4),肿瘤样本(n=10),癌旁样本(n=8)
胃癌(GC)的肿瘤微环境(TME)已被证明对肿瘤进展非常重要。从10位胃癌患者的癌及配对癌旁组织和血液中生成了一个单细胞图谱。研究表明,肿瘤相关基质细胞(TASCs)具有上调的 Wnt 信号转导和血管生成活性,并与生存率负相关。肿瘤相关巨噬细胞和 LAMP3+ DCs 参与介导 T 细胞活性,并与 TASCs细胞相互作用。克隆型和轨迹分析表明,Tc17(IL-17+CD8+ T cell)起源于组织驻留记忆T细胞,随后可分化为衰竭T细胞,这表明T细胞衰竭有另一种途径。此外,IL17+细胞可通过IL17、IL22和IL26信号传导促进肿瘤进展,突显了靶向IL17+细胞和相关信号通路作为治疗GC的一种可能性。
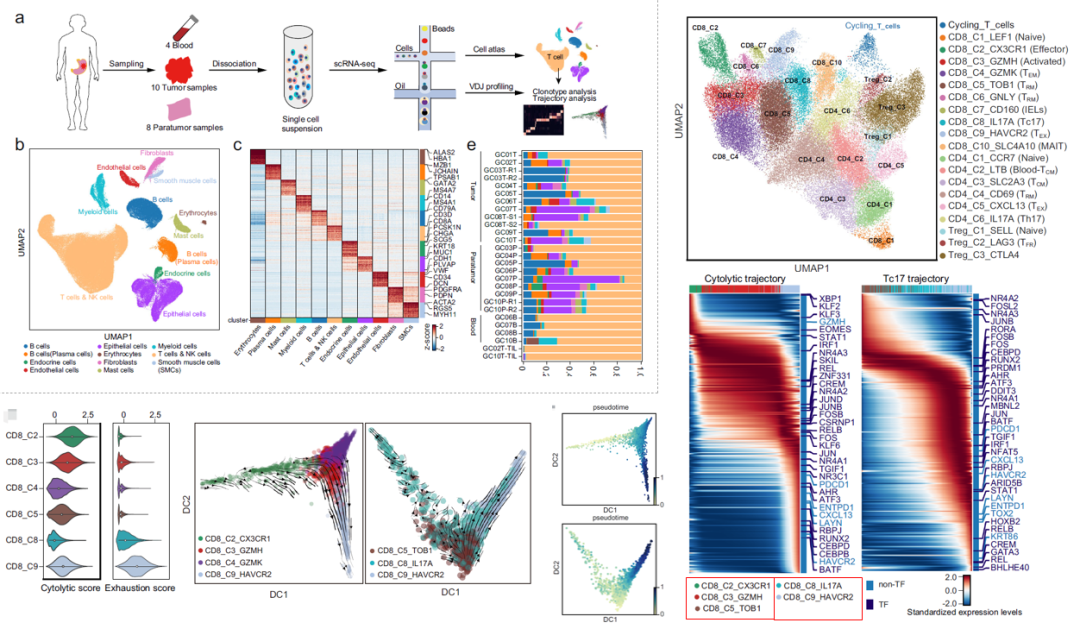
研究亮点:图谱分析+T细胞亚群+ CD8+T 细胞亚群的拟时序分析,发现了CD8+ T cell中细胞耗竭的另外一种信号转导途径。
研究案例三
文章题目:Dissecting transcriptional heterogeneity in primary gastric adenocarcinoma by single cell RNA sequencing
发表期刊:Gut (IF23)
发表时间:2021年
组学技术:单细胞转录组
实验设计:9个瘤组织(1个DGC,5个IGC,3个MGC)和3个癌旁样本
肿瘤异质性是胃腺癌(GA)诊断和治疗的主要障碍。利用scRNA-seq描绘了胃腺癌细胞异质性的转录图谱。对肿瘤细胞进行亚群分析,确定了五个具有不同表达特征的细胞亚群。不同肿瘤细胞亚群具有不同的分化程度,揭示了肿瘤内部和肿瘤之间分化程度的多样性,低分化特征细胞可能具有潜在的不良预后。肿瘤亚群C4高表达LIPF、PGC和RNF43,且Wnt/β-catenin信号通路被激活;与chief cell-predominant(GA-FG-CCP)的表型基本一致,此外,公共数据集也进一步证实了GA-FG-CCP 的存在。另一个亚组(C5)特异性表达与免疫相关的特征基因(如 LY6K,HLA-DPA1, HLA-DPB1)。此外,还对非恶性上皮进行了分析,证明gastric chief cells可能转变为MUC6+TFF2+ SPEM。总之,该研究为解读胃肿瘤异质性提供了宝贵的资源,有助于精确诊断和预后判断。
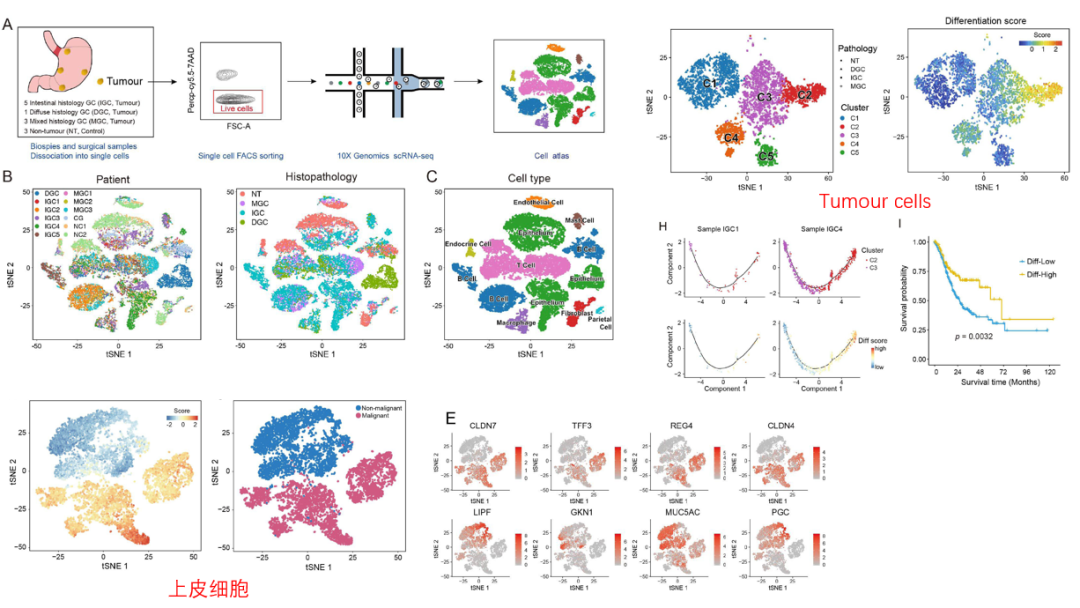
研究亮点:图谱分析+肿瘤亚群分析+特定亚群的拟时序分析,发现了具有不同转录表达特征的肿瘤细胞亚群。
研究案例四
文章题目:p57Kip2 imposes the reserve stem cell state of gastric chief cells
发表期刊:Cell Stem Cell (IF19.8)
发表时间:2022年
组学技术:单细胞转录组(Pgc+ cells),bulk RNA-seq(Troy+ cells)
实验设计:Uninjured (Control), DMP-777-induced corpus injury (Injury)
成体干细胞会不断对局部变化做出反应,以确保组织的平衡。主细胞(Chief cell)主要作用是分泌消化酶,如胃蛋白酶原及胃脂酶;一旦受伤,它们将迅速增殖,以促进组织再生。研究发现p57Kip2(p57)是小鼠Chief cell细胞转化为干细胞状态的一个分子开关。在稳态过程中,p57在Chief cell中持续表达,但在受伤后迅速减少,随后出现旺盛的增殖。单细胞RNA测序和系谱追踪都证实了p57的依次丢失和Chief cell内细胞增殖的激活。在corpus organoids中,p57过表达诱导了一种长期储备干细胞状态。体内实验表明:p57的持续表达诱导了Chief cell显示出受损的损伤反应。
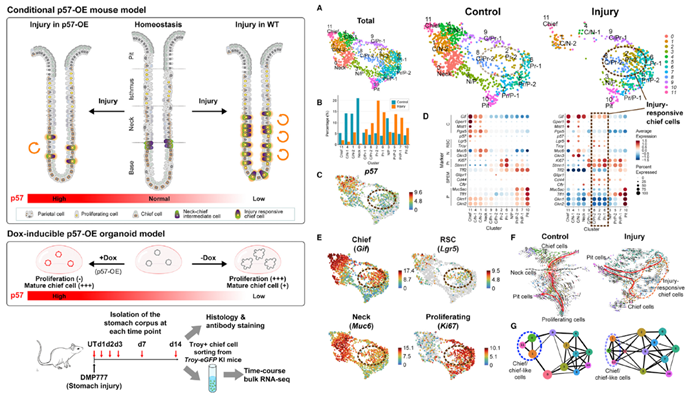
研究亮点:分选Pgc+ cells用于scRNA seq,鉴定了不同的细胞亚群,如chief cells, neck cells, proliferating cells, 和RSCs。此外,揭示了其分化轨迹,chief cells(C11)持续分化为C/Pr-2 (C8, injury responsive)和Pr-2 (C2, injury responsive),并最终分化为pit cells (C10)。
研究案例五
文章题目:Spatially resolved expression landscape and generegulatory network of human gastric corpus epithelium
发表期刊:Protein Cell (IF13.6)
发表时间:2023年
组学技术:单细胞转录组,空间转录组(10× Genomics Visium),single-cell ATAC-seq
实验设计:胃类器官
通过scRNA-seq、空间转录组和scATAC-seq进行整合分析,揭示了人胃黏膜上皮细胞的空间表达和基因调控网络。发现了一个干/祖细胞群,其中 EGF 和 WNT 信号通路被激活。同时,LGR4负责激活 WNT 信号通路。重要的是,发现并验证了 FABP5 和 NME1 对正常胃干/祖细胞和胃癌细胞都至关重要。最后,在染色质状态水平上探讨了胃黏膜上皮关键基因的表观遗传调控,并发现了几个重要的细胞类型特异性转录因子,如ID1, KLF2, KLF6, ATF3, ELF3, MYC这7个TF在progenitor 1中特异性表达。该研究为系统了解人胃黏膜上皮细胞多样性和体内平衡提供了新的见解。
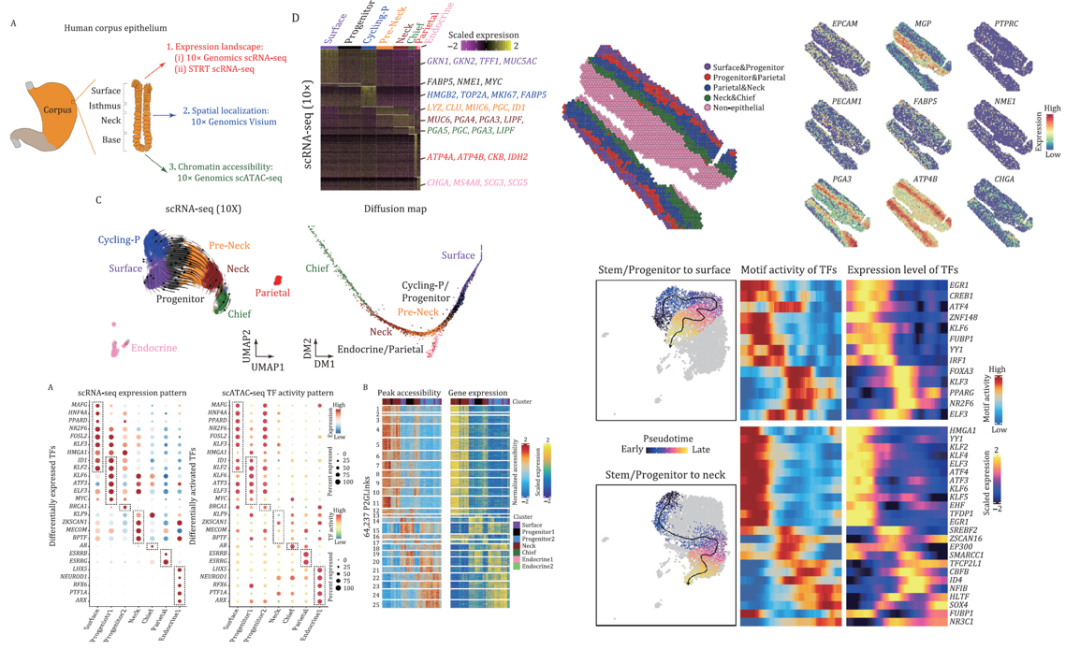
研究亮点:单细胞测序发现了一个干/祖细胞群,轨迹分析和空间转录组验证了该细胞群的存在,并对发现的关键性基因(FABP5 和 NME1)进行湿实验验证。此外,scATAC-seq也揭示了不同细胞类型特异性TF,为后续研究提供了新的理论支撑。
研究案例六
文章题目:Dynamic single-cell mapping unveils Epstein‒Barr virusimprinted T-cell exhaustion and on-treatment response
发表期刊:Signal Transduction and Targeted Therapy (IF40.8)
发表时间:2023年
组学技术:scRNA-seq和scTCR/BCR-seq
实验设计:免疫治疗(anti-PD-1+ XELOX/FOLFOX)前后
EBV相关胃癌的免疫治疗效果令人惊喜,然而,肿瘤免疫和治疗反应的作用机理基础仍未确定。本研究旨在通过scRNA-seq和scTCR/BCR-seq精细描述接受免疫化疗的EBV(+)GC患者的动态免疫环境。EBV (+) GC表现出炎症免疫表型,T细胞和B细胞浸润增加。免疫治疗(anti-PD-1+ XELOX/FOLFOX)会引发效应 T 细胞的克隆复苏,从而响应免疫治疗。通常情况下,抗原特异性 ISG-15+CD8+ T 细胞群在 EBV(+)GC 患者中高度富集,这代表了一种短暂的衰竭状态。重要的是,ISG-15+CD8+ T 细胞可预测 GC 患者对免疫疗法的反应。治疗后可发现原有的 ISG-15+CD8+ T 细胞克隆重新出现,进而诱导产生了表达 CXCL13 的效应细胞群。然而,LAG-3 retention可能会使non-responsive EBV (+) tumours的ISG-15+CD8+ T细胞进入终末衰竭状态。因此,anti-LAG-3 therapy可有效减轻难治性EBV(+)GC患者的肿瘤负荷。
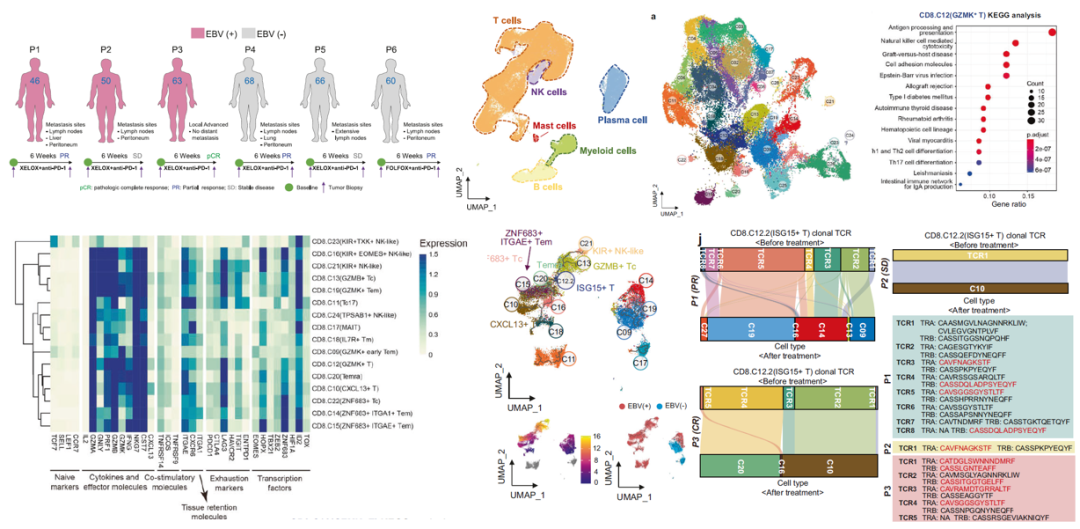
研究亮点:通过scRNA-seq和scTCR/BCR-seq精细描述了接受免疫化疗的EBV(+)GC患者的动态免疫环境。LAG-3可能促使ISG-15+CD8+ T细胞进入终末衰竭状态,因此,anti-LAG-3 疗法可有效减轻难治性EBV(+)GC患者的肿瘤负荷。
研究案例七
文章题目:Loss of ATOH1 in Pit Cell Drives Stemness and Progression of Gastric Adenocarcinoma by Activating AKT/mTOR Signaling through GAS1
发表期刊:Advanced Science (IF14.3)
发表时间:2023年
组学技术:scRNA-seq,bulk RNA-seq 和 ChIP-seq
实验设计:癌(n=8)和癌旁(n=11)
胃癌干细胞(GCSCs)是一种可自我更新的肿瘤细胞,它控制着胃腺癌(GAC)的抗癌能力,但其调控机制仍难以捉摸。该研究旨在阐明 ATOH1 在维持 GCSCs 中的作用。ATOH1缺乏与GAC的不良预后和化疗耐药性相关。scRNA-seq结果显示ATOH1在pit cells中下调。ATOH1缺失会使pit cells具有更强的干性。ATOH1 缺乏会抑制 GAS1 启动子,从而下调GAS1的表达;GAS1与RET形成复合物抑制Tyr1062磷酸化,从而激活RET/AKT/mTOR信号通路。化疗与靶向AKT/mTOR的药物联合使用,可以克服ATOH1缺乏引起的化疗耐药性。此外,证实了异常的DNA高甲基化会诱导ATOH1缺乏。综上所述,通过ATOH1/GAS1/RET/AKT/mTOR信号通路促进GAC的癌症干性,为AKT/mTOR抑制剂在ATOH1缺失的GAC患者中的应用提供了潜在的治疗策略。
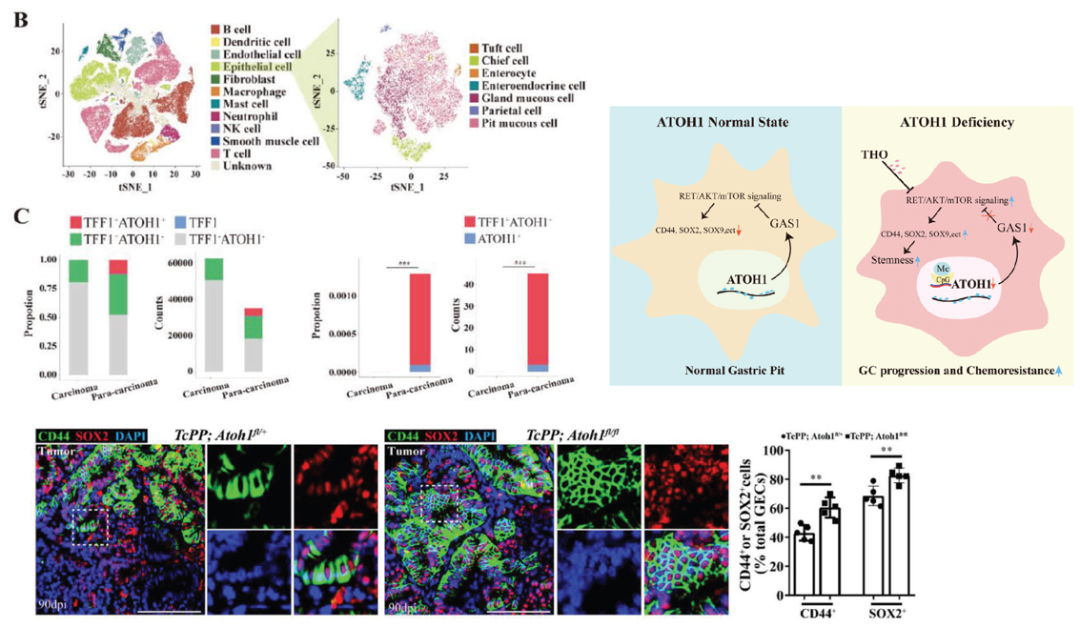
研究亮点:单细胞测序发现了ATOH1在pit cells中下调,明确了ATOH1在GAC癌症干性和耐药性中的作用机理。
研究案例八
文章题目:Loss of ATOH1 in Pit Cell Drives Stemness and Progression of Gastric Adenocarcinoma by Activating AKT/mTOR Signaling through GAS1
发表期刊:Gut (IF23)
发表时间:2023年
组学技术:scRNA-seq
实验设计:LGIN (n=1), WGCA (n=3), MGCA (n=3), PGCA (n=3)以及配对的正常组织样本
早期胃贲门腺癌(EGCA)是一种高度异质性癌症,利用scRNA-seq探讨了 EGCA 的细胞异质性。上皮细胞的整合分析表明,恶性上皮细胞亚群中很少检测到chief cells, parietal cells和enteroendocrine cells。而gland mucous cells, pit mucous cells和AQP5+ stem cells在恶性发展过程中占主导地位。拟时序和功能富集分析表明,WNT 和 NF-κB 信号通路在转变过程中被激活。对异质性恶性细胞的聚类分析显示,NNMT介导的烟酰胺代谢富集在胃粘蛋白表型细胞群中,这与肿瘤的发生和炎症诱导的血管生成有关。此外,在贲门腺癌的恶性发展过程中,NNMT的表达水平逐渐升高,并与预后不良有关。从机理上讲,NNMT 催化烟酰胺转化为1-methylnicotinamide,导致H3K27me3减少,进而激活 WNT 信号通路,在 EGCA 恶性进展过程中维持 AQP5+ 干细胞的干性。该研究拓展了对EGCA异质性的认识,并发现了可能驱动EGCA恶性进展的功能性NNMT+/AQP5+群体,可用于早期诊断和治疗。
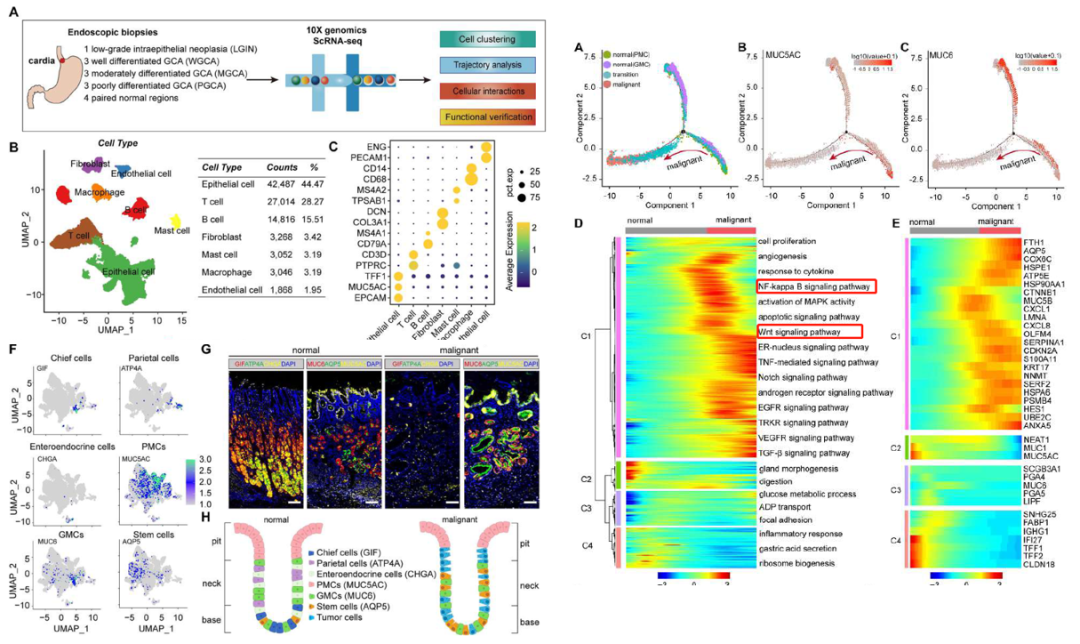
研究亮点:通过单细胞测序分析了恶性上皮细胞的细胞亚群的组成,拟时序分析揭示了WNT 和 NF-κB 信号通路在恶性上皮细胞转变过程中被激活。
研究案例九
文章题目:Epithelial SOX9 drives progression and metastases of gastric adenocarcinoma by promoting immunosuppressive tumour microenvironment
发表期刊:Gut (IF23)
发表时间:2023年
组学技术:scRNA-seq 和 Bulk RNA-seq
实验设计:来源于GAC 的PC cells (n=20)
腹膜转移(Peritoneal carcinomatosis ,PC)是胃癌的一种常见的转移形式,约在45%的患者中出现,该研究旨在剖析 SOX9 介导的癌症干性和免疫抑制微环境在晚期胃腺癌(GAC)中的作用。研究了PBMCs或CD45+免疫细胞与SOX9高表达或基因敲除的肿瘤细胞共培养的免疫反应,并通过SOX9高表达或基因敲除的肿瘤细胞与KP-Luc2共生模型来研究联合疗法的疗效。SOX9 是 GAC 中上调最多的 SOX 基因之一,在原发和转移组织中高表达,与预后不良有关。与来自GAC患者的PBMCs/CD45+细胞共培养时,患者来源的GAC细胞中SOX9的消耗可显著降低癌症干性、肿瘤形成和转移,并持续增加CD8+T细胞反应。Bulk RNA-seq确定LIF是肿瘤细胞中受 SOX9 调控的首要分泌分子,富集于恶性腹水中,并介导M2 巨噬细胞极化和抑制 T 细胞功能。LIF/LIFR和CSF1R共同靶向在SOX9介导的癌症干性、T细胞免疫抑制和转移方面具有巨大的潜力。
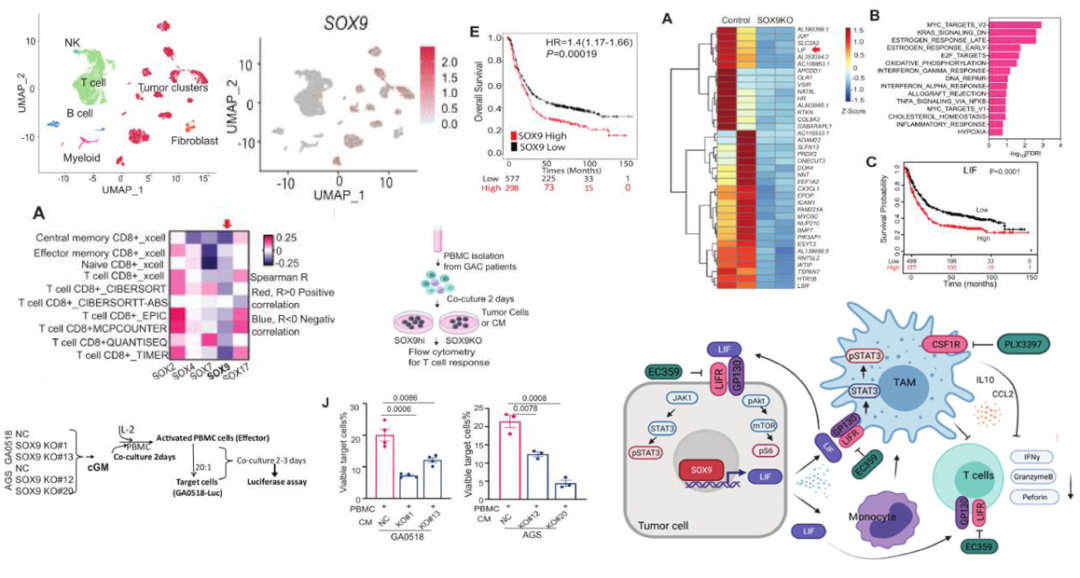
研究亮点:单细胞测序确定了SOX9 是肿瘤细胞中上调最多的 SOX 基因之一,进一步通过共培养细胞模型揭示了SOX9介导的癌症干性、T细胞免疫抑制和转移的作用机理。
研究案例十
文章题目:CCKBR+ cancer cells contribute to the intratumor heterogeneity of gastric cancer and confer sensitivity to FOXO inhibition
发表期刊:Cell Death & Differentiation (IF13.7)
发表时间:2024年
组学技术:scRNA-seq 和 CUT&Tag
实验设计:来源于5例胃腺癌患者的上皮细胞
通过单细胞测序(scRNA-seq)分析了5例胃腺癌患者的恶性上皮细胞,证明了胃腺癌的异质性,并确定了CCKBR+ stem cell-like cancer cells与临床预后差相关。此外,还发现 FOXOs 参与了 CCKBR+ 胃腺癌的发生发展。抑制 FOXOs 表达和破坏癌细胞干性可减少 CCKBR+ GA 类器官的形成并抑制肿瘤进展。CUT&Tag和pulldown发现,FOXOs能激活ST3GAL3/4/5和ST6GALNAC6,促进CCKBR+肿瘤细胞中sialyation水平的升高。FOXO-sialyltransferase轴有助于维持 CCKBR+肿瘤细胞的平衡和生长。这一观点为开发旨在治疗 CCKBR 相关胃癌的靶向治疗策略提供了新视角。
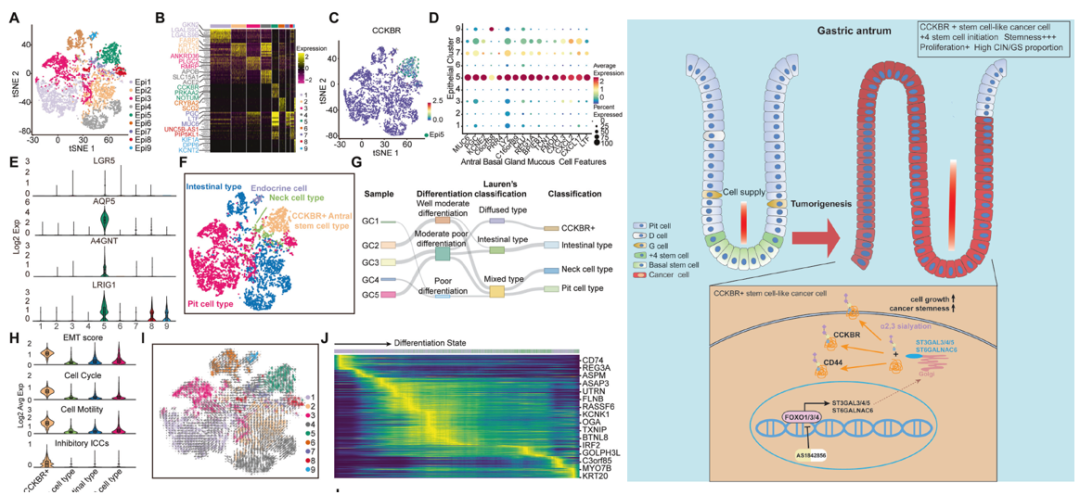
研究亮点:单细胞转录组发现了CCKBR+ stem cell-like cancer cells。此外,功能验证表明FOXO-sialyltransferase轴有助于维持 CCKBR+肿瘤细胞的平衡和生长。
业务咨询:15800353038









