和元生物技术(上海)股份有限公司品牌商
14 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
公司新闻/正文
干货 | CAR-NK和CAR-T各自的优点
1677 人阅读发布时间:2024-12-10 09:17
背景介绍
在癌症治疗领域,免疫疗法的兴起标志着一种全新的治疗手段,它通过激活或增强患者自身的免疫系统来对抗肿瘤。其中,嵌合抗原受体(CAR)技术的发展尤为引人注目,它使得免疫细胞能够被基因改造,以特异性地识别并消灭癌细胞。CAR-T细胞疗法,已经在某些血液肿瘤的治疗中取得了显著成效,如复发或难治性B细胞急性淋巴细胞性白血病(ALL)和多发性骨髓瘤。然而,CAR-T细胞疗法也面临着一些挑战,包括严重的副作用,如细胞因子释放综合征(CRS)和神经毒性。与CAR-T细胞相比,CAR-NK细胞具有一些独特的优势,包括不需要HLA配型、安全性问题较低,并且更适合“现成”的疗法,提供了比CAR-T细胞更大的运输优势。接下来,我们将深入探讨CAR-T和CAR-NK疗法的对比。
CAR-T疗法
CAR是由Eshhar等人首先提出并发明的,其目的是使T细胞的细胞毒性不受MHC限制,从而实现更广泛的适用性。T细胞是适应性免疫系统的关键组成成分,根据功能、共受体表达(CD4或CD8)、转运、代谢和寿命可分为不同的亚群,由于其强大的识别和消除癌细胞的能力,在对抗癌症中起着至关重要的作用。现阶段,关于T细胞免疫治疗方式主要有肿瘤浸润淋巴细胞(TIL)治疗、基因工程T细胞受体T(TCR-T)细胞治疗和CAR-T细胞治疗。
CAR-NK疗法
NK细胞是先天淋巴细胞,在抗肿瘤和病毒感染中起关键作用。NK细胞与炎症细胞因子的产生一起发挥快速而强大的细胞毒活。NK细胞通过多种MHC-l特异性抑制受体(包括抑制性杀伤细胞免疫球蛋白样受体(KIRs))检测MHC I类(MHC-I)分子。
NK识别和杀伤肿瘤细胞有多种方式,通过形成溶解性免疫突触来消灭靶细胞,并分泌含有颗粒酶B和穿孔素的溶解颗粒杀伤肿瘤细胞,识别肿瘤细胞表面的MHC-I缺失或低表达诱导杀伤,识别细胞表面上调的配体,如NK细胞可以通过CD16 (FCyRIII)介导IgG活化的细胞毒性,CD16与IgG抗体的Fc部分结合诱导肿瘤细胞凋亡;NK细胞可以产生多种促炎细胞因子,包括IFN-γ和TNF-α,以限制靶细胞的生长并协调其他先天和适应性免疫细胞的功能;NK细胞转而使用死亡受体,如Fas配体和tnf相关凋亡诱导配体(TRAIL),诱导靶细胞死亡以及抗体依赖性细胞毒性机制(ADCC)。
CAR-NK和CAR-T比较与策略
GvHD(移植物抗宿主病)和HvG(宿主抗移植物反应)
CAR-T治疗中,通常使用供体来源的细胞来避免GvHD和输入细胞的排斥反应,即宿主抗移植物(HvG)反应。但是自体CAR-T制备过程漫长,步骤繁琐,因此使用“通用型”产品可能是目前的理想选择,可以采取不同的策略来降低和限制CAR-T细胞诱导的GvHD的风险。
这一风险主要取决于功能性αßTCR的表达,因此CAR-T细胞可以通过基因修饰使其不表达TCRα链,并作为异体产物使用。
CAR-NK细胞在同种异体环境中不诱导GvHD的优势,因此不需要任何额外的基因编辑就可以用作“现成”的治疗方法。现有的NK-92细胞系或来自异体供体的原代NK细胞可以被利用并通过大规模生产进行生产。相反,同种异体TCRα-链CAR-T细胞和CAR-NK细胞在免疫功能正常的患者中使用时仍然容易发生HvG反应。
在血液系统恶性肿瘤中,在治疗过程中可能扰乱受体免疫系统,因此可以选择不同的方法来避免排斥反应。比如敲除CAR细胞上的常见淋巴细胞抗原CD52。在实体瘤的治疗中,如果细胞治疗时需要保护宿主,就需要与宿主自身的免疫系统稳态抗衡,而通过基因编辑的方式过表达非经典HLA-E是一种不错的方式。
细胞因子风暴和神经毒性
CAR-T细胞活化通常会导致炎性细胞因子的释放,从而导致细胞因子风暴(CRS)和神经毒性。然而,CAR-NK细胞释放不同的细胞因子。接受同种异体CAR-NK细胞治疗的患者没有发生CRS或神经毒性,也没有表现出IL-1β、IL-6和IL-10等促炎细胞因子水平的增加。与CAR-T细胞相比,CAR-NK细胞很少与CRS相关,且与神经毒性无关。这表明,对于这些严重的副作用,CAR-NK细胞可能比CAR-T细胞更安全。
实体瘤治疗
多种肿瘤识别机制由于CAR-NK细胞可以通过抗原依赖性和抗原非依赖性两种方式识别和消除癌细胞,与CAR-T相比,这种疗法在实体肿瘤的应用可能具有显著优势。相比之下,NK细胞天然具有抗原非依赖性机制,可能对异质性的肿瘤有益。此外,NK细胞可以通过CD16介导ADCC,CD16与癌细胞上IgG的Fc结构域结合。这进一步增强了它们对抗实体瘤的潜在有效性。
病毒转导抗性
尽管CAR-NK具有很好的特性,但仍存在一些显著的局限性,阻碍了其在实体肿瘤治疗中的成功应用。许多这些局限性与CAR-T疗法相似,如肿瘤浸润不良和与TME的有害相互作用。此外,NK细胞有其独特的生物学和功能的特定限制。对病毒转导的抗性CAR-NK细胞应用的主要限制之一是与T细胞相比NK细胞对病毒转导的抗性。
使用γ逆转录病毒并且在转导前一天用IL-2和饲养细胞刺激NK细胞阳性率范围很广(从22.7%到91.1%),这是一个显著的局限性。利用逆转录病毒偏爱感染主动复制细胞的特性,获得的。目前FDA批准的6种CAR-T细胞产品中,4种采用慢病毒载体,2种采用y逆转录病毒载体。尽管目前没有临床数据表明一种策略比另一种策略更优越或更安全,但至少对于当前一代的病毒载体来说,必须注意的是,γ型逆转录病毒优先插入增强子和启动子附近,这意味着与慢病毒载体相比,插入突变的风险更高。出于这个原因,需要探索不同的方式来改造慢病毒,来解决慢病毒在NK细胞中引发的抗病毒反应。
总结
CAR-T和CAR-NK细胞治疗在免疫疗法领域各有优势和局限性。创新的生物技术工具对改进CAR免疫疗法的贡献才刚刚开始显示其潜力,更多方法还需要进一步的探索。
和元助力
和元生物致力于病毒载体的研发,基于十余年病毒领域的深耕,拥有优化的载体和独有的Vpack专利包装系统提升CAR慢病毒产量,可为研究者提供CAR载体的经典设计,病毒包装、体内外功能验证等一站式服务,助力科学研究!
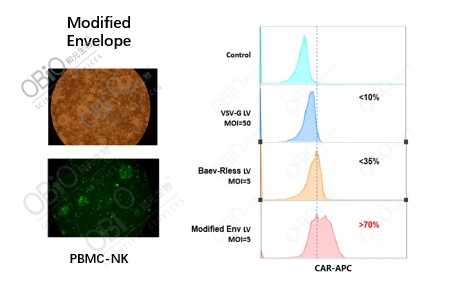
参考文献:
[1]Peng L, Sferruzza G, Yang L, Zhou L, Chen S. CAR-T and CAR-NK as cellular cancer immunotherapy for solid tumors. Cell Mol Immunol. 2024 Oct;21(10):1089-1108. doi: 10.1038/s41423-024-01207-0. Epub 2024 Aug 12. PMID: 39134804; PMCID: PMC11442786.
[2] Zhong Y, Liu J. Emerging roles of CAR-NK cell therapies in tumor immunotherapy: current status and future directions. Cell Death Discov. 2024 Jul 10;10(1):318. doi: 10.1038/s41420-024-02077-1. PMID: 38987565; PMCID: PMC11236993.
[3]Morris EC, Neelapu SS, Giavridis T, Sadelain M. Cytokine release syndrome and associated neurotoxicity in cancer immunotherapy. Nat Rev Immunol. 2022;22:85–96.
[4]Norelli M, Camisa B, Barbiera G, Falcone L, Purevdorj A, Genua M, et al. Monocyte-derived IL-1 and IL-6 are differentially required for cytokine-release syndrome and neurotoxicity due to CAR T cells. Nat Med. 2018;24:739–48.
[5] Shimabukuro-Vornhagen A, Gödel P, Subklewe M, Stemmler HJ, Schlößer HA, Schlaak M, et al. Cytokine release syndrome. J Immunother Cancer. 2018;6:56.
[6] Lee DW, Santomasso BD, Locke FL, Ghobadi A, Turtle CJ, Brudno JN, et al. ASTCT consensus grading for cytokine release syndrome and neurologic toxicity associated with immune effector cells. Biol Blood Marrow Transplant J Am Soc Blood Marrow Transplant. 2019;25:625–38.







